Είναι το διοξείδιο του άνθρακα (CO2) πολικό ή μη πολικό;
Το διοξείδιο του άνθρακα (CO2) είναι μη πολικό επειδή έχει γραμμική, συμμετρική δομή, με 2 άτομα οξυγόνου ίσης ηλεκτραρνητικότητας που τραβούν την πυκνότητα ηλεκτρονίων από τον άνθρακα υπό γωνία 180 μοιρών από κάθε κατεύθυνση. Η πολικότητα σε ένα μόριο συμβαίνει λόγω της άνισης κατανομής των ηλεκτρονίων σθένους. Δεδομένου ότι δεν υπάρχει άνιση κατανομή των ηλεκτρονίων σθένους στην περίπτωση του διοξειδίου του άνθρακα, είναι μη πολικό.
Ωστόσο, προτού φτάσουμε στο τέλος αυτού του θέματος, βοηθάει να κατανοήσουμε πρώτα μερικές υποκείμενες έννοιες σχετικά με την πολικότητα ενός μορίου.
Τι είναι η πολικότητα;
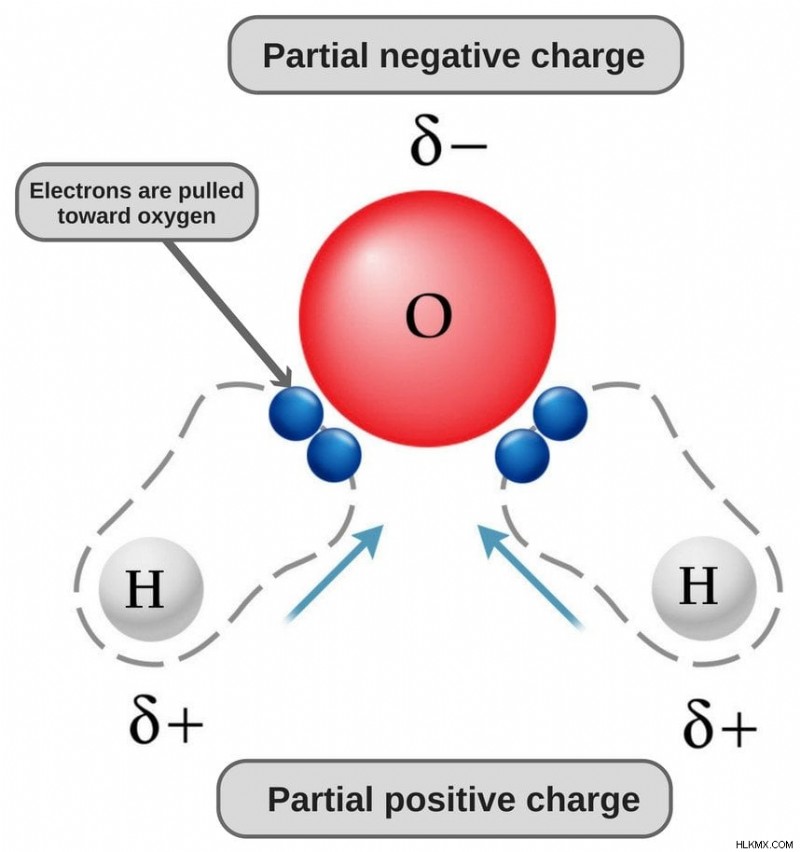
Τα μόρια που έχουν περιοχές θετικού και αρνητικού φορτίου αναφέρονται ως «πολικά» και αυτή η ιδιότητα τέτοιων μορίων ονομάζεται πολικότητα.
Πάρτε νερό, για παράδειγμα. Λόγω της λυγισμένης δομής του και του τύπου των δεσμών που έχει, το ένα άκρο του μορίου του (δηλαδή το άκρο του οξυγόνου) έχει ένα ελαφρύ αρνητικό φορτίο, ενώ το άλλο άκρο έχει ένα ελαφρύ θετικό φορτίο (δηλαδή το άκρο του υδρογόνου). Αυτό κάνει το νερό πολικό μόριο.
 Ομοίως, τα μόρια που δεν έχουν περιοχές θετικού και αρνητικού φορτίου αναφέρονται ως μη πολικά. Το αιθάνιο, για παράδειγμα, είναι ένα μη πολικό μόριο. Το σχήμα που έχει και ο τύπος των δεσμών από τους οποίους αποτελείται, το αφήνουν χωρίς περιοχές φόρτισης.
Ομοίως, τα μόρια που δεν έχουν περιοχές θετικού και αρνητικού φορτίου αναφέρονται ως μη πολικά. Το αιθάνιο, για παράδειγμα, είναι ένα μη πολικό μόριο. Το σχήμα που έχει και ο τύπος των δεσμών από τους οποίους αποτελείται, το αφήνουν χωρίς περιοχές φόρτισης.
Υπάρχει μια έννοια στη χημεία που λέει ότι «τα αρέσουν διαλύουν τα αρεστά». Αυτό είναι στην πραγματικότητα μια αναφορά στη διαλυτότητα μιας ουσίας σε μια άλλη. Τα πολικά υλικά τείνουν να είναι πιο διαλυτά σε πολικούς διαλύτες και το ίδιο ισχύει για τα μη πολικά υλικά.
Τι κάνει ένα μόριο πολικό;
Η πολικότητα ενός μορίου σχετίζεται με τη μετατόπιση των ηλεκτρονίων σε μια συγκεκριμένη κατεύθυνση. Αυτό, με τη σειρά του, εξαρτάται από την πολικότητα των δεσμών που υπάρχουν στο μόριο, καθώς αυτοί οι δεσμοί περιέχουν επίσης ηλεκτρόνια.
Ο δεσμός μεταξύ δύο ατόμων λέγεται ότι είναι πολικός εάν και τα δύο άτομα είναι διαφορετικά, γιατί εάν και τα δύο άτομα είναι ίδια, τότε οι πυρήνες και των δύο αυτών ατόμων θα κρατήσουν τα ηλεκτρόνια τους και κατά συνέπεια, αυτά τα ηλεκτρόνια δεν θα μπορούν να μετατοπιστούν οποιαδήποτε κατεύθυνση. Από την άλλη πλευρά, εάν τα δύο άτομα είναι διαφορετικά, θα έχουν σίγουρα ανόμοιες δυνάμεις για να προσελκύσουν τα ηλεκτρόνια του δεσμού.
Ως εκ τούτου, το άτομο με την υψηλότερη ισχύ να προσελκύει ηλεκτρόνια προς τον εαυτό του (δηλαδή είναι πιο ηλεκτραρνητικό από το άλλο άτομο), θα αποκτήσει ένα ελαφρύ αρνητικό φορτίο πάνω του και ο δεσμός μεταξύ των δύο ατόμων θα γίνει πολικός.
Συνολικά, θα μπορούσατε να πείτε ότι η πυκνότητα ηλεκτρονίων ενός πολικού δεσμού συσσωρεύεται προς το ένα άκρο του δεσμού, με αποτέλεσμα αυτό το άκρο να έχει ένα ελαφρύ αρνητικό φορτίο, ενώ το άλλο άκρο έχει ένα ελαφρύ θετικό φορτίο. Αυτό κάνει ένα μόριο πολικό. Ομοίως, εάν ένα μόριο δεν έχει περιοχές θετικού και αρνητικού φορτίου, θεωρείται μη πολικό.
Ωστόσο, ένα ενδιαφέρον πράγμα που πρέπει να σημειωθεί είναι ότι όσο μεγαλύτερη είναι η διαφορά ηλεκτραρνητικότητας, τόσο πιο πολικός θα είναι ο δεσμός μέσα σε ένα μόριο. Οι καρβονυλικές ενώσεις είναι πολικές επειδή ο άνθρακας καρβονυλίου είναι ελαφρώς θετικός. Επομένως, το διοξείδιο του άνθρακα, το οποίο περιέχει έναν θετικό άνθρακα και δύο μερικώς αρνητικά οξυγόνα, δεν θα πρέπει να είναι πολικό;
Γιατί το διοξείδιο του άνθρακα είναι μη πολικό;
Εάν ένα μόριο αποτελείται από περισσότερους από έναν δεσμούς, τότε πρέπει να ληφθεί υπόψη η συνδυασμένη επίδραση όλων αυτών των δεσμών. Ας δούμε τη δομή του διοξειδίου του άνθρακα:
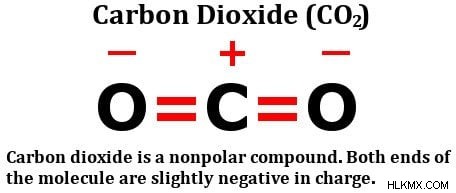
Όπως μπορείτε να δείτε ξεκάθαρα, το μόριο έχει ένα άτομο άνθρακα που μοιράζεται δύο διπλούς δεσμούς με το οξυγόνο. Σίγουρα, το οξυγόνο είναι πιο ηλεκτραρνητικό από τον άνθρακα, επομένως, θα μπορούσε κανείς να σκεφτεί ότι τα ηλεκτρόνια που υπάρχουν στον δεσμό μεταξύ άνθρακα και οξυγόνου θα έλκονταν προς το άτομο οξυγόνου.
Ωστόσο, αυτό δεν συμβαίνει πραγματικά. Ο λόγος βρίσκεται στη γεωμετρία του μορίου. Όπως μπορείτε να δείτε, και οι δύο αυτοί διπλοί δεσμοί βρίσκονται σε απόσταση 180 μοιρών από το κεντρικό άτομο άνθρακα. Επομένως, καθώς το άτομο οξυγόνου στα δεξιά προσπαθεί να τραβήξει την πυκνότητα ηλεκτρονίων από τον άνθρακα πάνω από τον εαυτό του, το (άλλο) άτομο οξυγόνου, δηλ. αυτό στα αριστερά, τραβάει την πυκνότητα ηλεκτρονίων πάνω του με ίση δύναμη.
Το αποτέλεσμα είναι ότι δεν υπάρχει καθαρή μετατόπιση ηλεκτρονίων προς οποιαδήποτε κατεύθυνση, επομένως δεν υπάρχει συσσώρευση καθαρών φορτίων σε κανένα από τα άτομα, καθιστώντας το μόριο διοξειδίου του άνθρακα μη πολικό.









