Διαφορά μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων
Κύρια διαφορά – Κορεσμένοι έναντι ακόρεστων υδρογονανθράκων
Οι υδρογονάνθρακες είναι οργανικές ενώσεις που περιέχουν μόνο άτομα άνθρακα και υδρογόνου. Οι υδρογονάνθρακες θεωρούνται ως μητρικές ενώσεις πολλών οργανικών ενώσεων. Η κύρια αλυσίδα των υδρογονανθράκων δημιουργείται από τους δεσμούς C-C και τα άτομα υδρογόνου συνδέονται με άτομα άνθρακα στην κύρια αλυσίδα. Με βάση την παρουσία απλών ή πολλαπλών δεσμών μεταξύ ατόμων άνθρακα, οι υδρογονάνθρακες ταξινομούνται σε δύο ομάδες και συγκεκριμένα. κορεσμένους υδρογονάνθρακες και ακόρεστους υδρογονάνθρακες. Η κύρια διαφορά μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων είναι ότι οι κορεσμένοι υδρογονάνθρακες περιέχουν μόνο απλούς ομοιοπολικούς δεσμούς μεταξύ των ατόμων άνθρακα, λαμβάνοντας υπόψη ότι οι ακόρεστοι υδρογονάνθρακες περιέχουν τουλάχιστον έναν διπλό ή τριπλό ομοιοπολικό δεσμό στην κύρια αλυσίδα . Οι κορεσμένοι και οι ακόρεστοι υδρογονάνθρακες παρουσιάζουν διαφορετικά χαρακτηριστικά λόγω αυτών των δομικών διαφορών.
Βασικές περιοχές που καλύπτονται
1. Τι είναι κορεσμένοι υδρογονάνθρακες
– Ορισμός, Δομή, Τύποι, Ιδιότητες
2. Τι είναι οι ακόρεστοι υδρογονάνθρακες
– Ορισμός, Δομή, Τύποι, Ιδιότητες
3. Ποια είναι η διαφορά μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:υδρογονάνθρακες, κορεσμένοι υδρογονάνθρακες, ακόρεστοι υδρογονάνθρακες, ομοιοπολικοί δεσμοί, αλκάνια, αλκένια, αλκίνια, αρωματικοί υδρογονάνθρακες

Τι είναι οι Κορεσμένοι Υδρογονάνθρακες
Οι υδρογονάνθρακες στους οποίους όλα τα άτομα άνθρακα συνδέονται με άλλα άτομα με απλούς ομοιοπολικούς δεσμούς ονομάζονται κορεσμένοι υδρογονάνθρακες. Έτσι, οι κορεσμένοι υδρογονάνθρακες δεν περιέχουν πολλαπλούς δεσμούς, συμπεριλαμβανομένων διπλών ή τριπλών ομοιοπολικών δεσμών. Σε αυτές τις ενώσεις, κάθε άτομο άνθρακα συνδέεται απευθείας με τέσσερα άλλα άτομα. Ως εκ τούτου, όλα τα άτομα άνθρακα καταλαμβάνονται πλήρως δημιουργώντας τέσσερις δεσμούς. Αυτός είναι ο λόγος που αυτές οι ενώσεις ονομάζονται κορεσμένοι υδρογονάνθρακες. Οι κορεσμένοι υδρογονάνθρακες είναι τα απλούστερα και τα λιγότερο πολικά οργανικά φυσικά προϊόντα. Παραδείγματα κορεσμένων υδρογονανθράκων περιλαμβάνουν αλκάνια και οικογένειες υδρογονανθράκων κυκλοαλκανίων.
Η απλούστερη μορφή κορεσμένων υδρογονανθράκων περιλαμβάνει το μεθάνιο (CH4 ), αιθάνιο (C2 H6 ), προπάνιο (C3 H8 ) κλπ. Οι κορεσμένοι υδρογονάνθρακες καίγονται και δίνουν μια μπλε, μη αιθάλη φλόγα στον αέρα. Λόγω της ευφλεκτότητας των κορεσμένων υδρογονανθράκων που τελικά απελευθερώνουν πολλή ενέργεια, οι κορεσμένοι υδρογονάνθρακες χρησιμοποιούνται συχνά ως πηγή καυσίμου για κινητήρες οχημάτων και αεροπλάνων. Το γνωστό υγραέριο ή αέριο μαγειρέματος είναι επίσης ένας κορεσμένος υδρογονάνθρακας που ονομάζεται βουτάνιο (C4 H10 ). Η καύση των αλκανίων με τον αέρα θα έχει ως αποτέλεσμα διοξείδιο του άνθρακα, αέριο, υδρατμούς, θερμότητα και φως. Οι υδρογονάνθρακες λαμβάνονται συνήθως από απολιθωμένα φυτικά και ζωικά υλικά. Μόλις ληφθούν ως αργό πετρέλαιο, η διαδικασία που ονομάζεται απόσταξη χρησιμοποιείται για να διαχωριστούν διάφορα προϊόντα ανάλογα με τη μάζα τους. Όλη αυτή η διαδικασία ονομάζεται διύλιση αργού πετρελαίου.
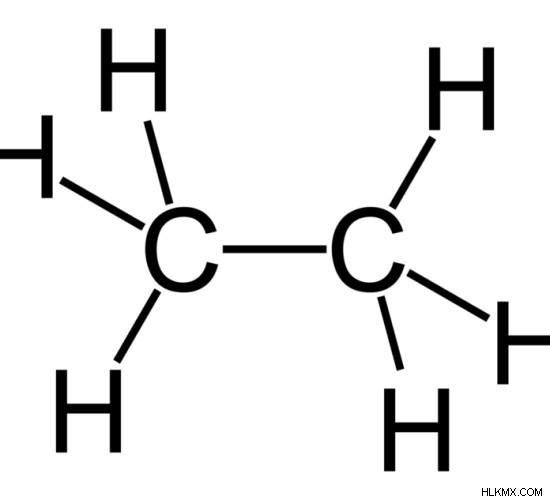
Εικόνα 1:Αιθάνιο
Τι είναι οι ακόρεστοι υδρογονάνθρακες
Οι ακόρεστοι υδρογονάνθρακες είναι οι υδρογονάνθρακες που περιέχουν τουλάχιστον έναν διπλό ή τριπλό δεσμό άνθρακα-άνθρακα στην ανθρακική αλυσίδα ή τον δακτύλιο τους. Αυτές οι ενώσεις έχουν παρόμοιες φυσικές ιδιότητες με εκείνες των κορεσμένων υδρογονανθράκων. Ωστόσο, οι χημικές τους ιδιότητες είναι πολύ διαφορετικές από τους κορεσμένους υδρογονάνθρακες κυρίως λόγω της παρουσίας πολλαπλών δεσμών. Συνήθως, οι χημικές αντιδράσεις ξεκινούν από τοποθεσίες όπου υπάρχουν πολλοί δεσμοί στην ανθρακική αλυσίδα. Ως εκ τούτου, η αντιδραστικότητα των ακόρεστων υδρογονανθράκων αυξάνεται με έναν αριθμό πολλαπλών δεσμών που υπάρχουν στην κύρια αλυσίδα.
Τύποι ακόρεστων υδρογονανθράκων
Υπάρχουν τρεις τύποι ακόρεστων υδρογονανθράκων, και συγκεκριμένα; (α) αλκένια , που περιέχουν έναν ή περισσότερους διπλούς δεσμούς (C=C), (β) αλκύνια , που περιέχει έναν ή περισσότερους τριπλούς δεσμούς (C≡C) και (γ) αρωματικούς υδρογονάνθρακες , τα οποία αποτελούνται από έναν αποτοπισμένο δεσμό που έχει ως αποτέλεσμα έναν εξαμελή δακτύλιο άνθρακα. Παραδείγματα αλκενίων περιλαμβάνουν αιθένιο, προπένιο, βουτένιο, κ.λπ. Ακετυλένιο, προπίνιο, βουτύλιο είναι μερικά παραδείγματα για αλκίνια. Το βενζόλιο, το τολουόλιο, η ανιλίνη είναι μερικά κοινά παραδείγματα αρωματικών υδρογονανθράκων. Η απλούστερη μορφή ακόρεστου υδρογονάνθρακα είναι το αιθυλένιο, το οποίο είναι σημαντικό ως φυτική ορμόνη που ενεργοποιεί την ωρίμανση των καρπών.
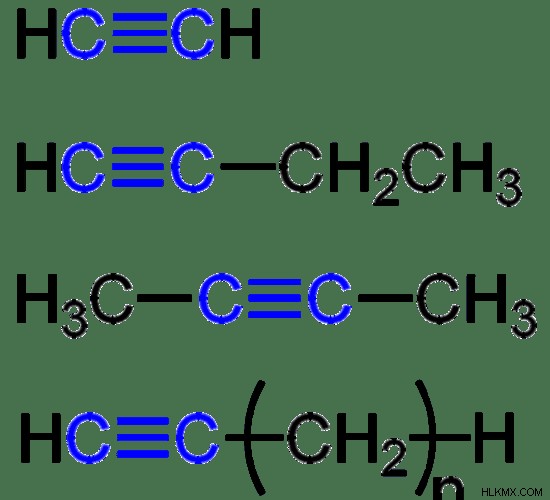
Εικόνα 2:Μερικά αλκύνια
Διαφορά μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων
Ορισμός
Κορεσμένοι υδρογονάνθρακες: Οι κορεσμένοι υδρογονάνθρακες είναι υδρογονάνθρακες με μόνο μονοπολικούς δεσμούς.
Ακόρεστοι υδρογονάνθρακες: Οι ακόρεστοι υδρογονάνθρακες είναι υδρογονάνθρακες με πολλαπλούς ομοιοπολικούς δεσμούς (διπλούς και τριπλούς δεσμούς).
Τύποι
Κορεσμένοι υδρογονάνθρακες: Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες.
Ακόρεστοι υδρογονάνθρακες: Τα αλκένια, τα αλκίνια και οι αρωματικοί υδρογονάνθρακες είναι τύποι ακόρεστων υδρογονανθράκων.
Αντιδραστικότητα
Κορεσμένοι υδρογονάνθρακες: Οι κορεσμένοι υδρογονάνθρακες είναι λιγότερο αντιδραστικοί.
Ακόρεστοι υδρογονάνθρακες: Οι ακόρεστοι υδρογονάνθρακες είναι πιο αντιδραστικοί.
Κάψιμο στον αέρα
Κορεσμένοι υδρογονάνθρακες: Η καύση κορεσμένων υδρογονανθράκων έχει ως αποτέλεσμα μια μπλε φλόγα χωρίς αιθάλη.
Ακόρεστοι υδρογονάνθρακες: Η καύση ακόρεστων υδρογονανθράκων έχει ως αποτέλεσμα μια κίτρινη φλόγα αιθάλης.
Ποσότητα άνθρακα και υδρογόνου
Κορεσμένοι υδρογονάνθρακες: Οι κορεσμένοι υδρογονάνθρακες έχουν μικρότερη ποσότητα άνθρακα και υψηλή ποσότητα υδρογόνου.
Ακόρεστοι υδρογονάνθρακες: Οι ακόρεστοι υδρογονάνθρακες έχουν υψηλή ποσότητα άνθρακα και λιγότερη ποσότητα υδρογόνου
Πηγές
Κορεσμένοι υδρογονάνθρακες: Αυτά λαμβάνονται συνήθως από απολιθωμένα φυτικά και ζωικά υλικά.
Ακόρεστοι υδρογονάνθρακες: Λαμβάνονται κυρίως από φυτά (φυτικές χρωστικές ουσίες, κεριά, πρωτεΐνες, φυτικά έλαια κ.λπ.)
Συμπέρασμα
Η διαφορά μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων εξαρτάται από τους τύπους δεσμών που περιέχουν. Οι κορεσμένοι υδρογονάνθρακες περιέχουν μόνο απλούς ομοιοπολικούς δεσμούς ενώ οι ακόρεστοι υδρογονάνθρακες περιέχουν τουλάχιστον έναν ή περισσότερους διπλούς ή τριπλούς δεσμούς άνθρακα-άνθρακα. Ως εκ τούτου, οι ακόρεστοι υδρογονάνθρακες είναι πιο δραστικοί από τους κορεσμένους υδρογονάνθρακες. Οι κορεσμένοι υδρογονάνθρακες περιλαμβάνουν τα αλκάνια, ενώ οι ακόρεστοι υδρογονάνθρακες περιλαμβάνουν τα αλκένια, τα αλκίνια και τους αρωματικούς υδρογονάνθρακες.
Αναφορές:
1. Cseke, Leland J., Ara Kirakosyan, Peter B. Kaufman, Sara Warber, James A. Duke και Harry L. Brielmann. Φυσικά προϊόντα από φυτά. Boca Raton, FL:CRC Press, 2006. Print
2. Singh, Lakmir και Manjit Kaur. Επιστήμη για Δέκατη Τάξη Μέρος 2 Φυσική. N.p.:S. Chand, 2016. Print.
3. Stoker, H. Stephen. Γενική, οργανική και βιολογική χημεία. 6η έκδ. N.p.:Cengage Learning, 2012. Εκτύπωση.
Ευγενική προσφορά εικόνας:
1. "Ethane-2D" (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Alkyne General Formulas V" By Jü – Own work (CC0) μέσω Commons Wikimedia




