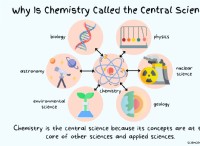
Ηλεκτρόφιλη προσθήκη
Ένα μόριο που έχει την τάση να αντιδρά με άλλα μόρια που περιέχουν ένα δοθέν ζεύγος ηλεκτρονίων είναι ηλεκτρόφιλο. Ένα μόριο που περιέχει ένα δωρεά ζεύγος ηλεκτρονίων ή ένα μοναχικό ζεύγος που μπορεί εύκολα να μοιραστεί με το ηλεκτρόφιλο είναι ένα πυρηνόφιλο. Ένας τύπος αντίδρασης στην οποία ένα ηλεκτρόφιλο και ένα πυρηνόφιλο αντιδρούν μαζί και προστίθενται σε διπλό ή τριπλό δεσμό ονομάζεται ηλεκτρόφιλη αντίδραση προσθήκης.
Μια ευρεία ποικιλία χρήσιμων προϊόντων λαμβάνεται μέσω ηλεκτροφιλικών αντιδράσεων. Ηλεκτρόφιλες αντιδράσεις προσθήκης παρατηρούνται σε ενώσεις που περιέχουν δεσμούς Pi, επομένως η αντίδραση περιλαμβάνει την αφαίρεση ενός δεσμού Pi και τη δημιουργία ενός άλλου δεσμού Sigma σε αυτόν.
Αντίδραση προσθήκης
Όταν δύο ή περισσότερα μόρια συνδυάζονται για να σχηματίσουν μια προσθήκη ή προσθήκη, το αποτέλεσμα είναι μια αντίδραση προσθήκης. Είναι μια κοινή αντίδραση οργανικής χημείας. Το εύρος αυτής της αντίδρασης περιορίζεται σε μόρια που έχουν ακόρεστο. Για να προχωρήσουμε λοιπόν σε μια αντίδραση προσθήκης, πρέπει να υπάρχει διπλός ή τριπλός δεσμός.
Μια ηλεκτρόφιλη αντίδραση προσθήκης είναι ένας τύπος αντίδρασης προσθήκης στην οποία μόρια που έχουν ακόρεστο, όπως ένας διπλός ή τριπλός δεσμός, υφίστανται μια αντίδραση προσθήκης με το σχηματισμό ενός ενδιάμεσου ηλεκτροφίλου. Ως εκ τούτου, ονομάζεται ηλεκτρόφιλη προσθήκη. Ονομάζεται επίσης αντίστροφη αντίδραση αποβολής.
Έννοια της Ηλεκτρόφιλης Προσθήκης
Μια ηλεκτρόφιλη αντίδραση προσθήκης έχει ευρεία εφαρμογή στην οργανική χημεία. Μια χημική ένωση ή μια οργανική ένωση που έχει διπλό ή τριπλό δεσμό - που περιέχει δεσμό Pi - υφίσταται αυτήν την αντίδραση. Ο δεσμός που υπάρχει στον διπλό ή τριπλό δεσμό σπάει και με τη σειρά του σχηματίζεται ένας νέος δεσμός σίγμα.
Συμπλεκόμενα βήματα
Τα στάδια για τις αντιδράσεις ηλεκτρόφιλης προσθήκης περιλαμβάνουν τον σχηματισμό ενός ενδιάμεσου καρβοκατιόντος. Ένα μόριο που έχει κέντρο πλούσιο σε ηλεκτρόνια ή ακόρεστο προσβάλλεται πρώτα από ένα ηλεκτρόφιλο H+ από το HBr. Στη συνέχεια, σχηματίζεται δεσμός με τον άνθρακα και το ηλεκτρόφιλο. Αργότερα, αυτό έχει ως αποτέλεσμα το σχηματισμό ενός σχηματισμού καρβοκατιόντος του ομοιοπολικού δεσμού μεταξύ του άνθρακα και του ηλεκτρόφιλου. Η αντίδραση που συμβαίνει με αυτόν τον τρόπο φαίνεται παρακάτω:-

Στο πρώτο βήμα, σχηματίζεται ένα καρβοκατιόν, το οποίο αντιδρά με άλλο είδος πλούσιο σε ηλεκτρόνια για να σχηματίσει έναν άλλο σίγμα δεσμό ή ομοιοπολικό. Το σπάσιμο του δεσμού pi περιλαμβάνει το σχηματισμό δύο δεσμών σίγμα.
Η αντίδραση ηλεκτροφιλικής προσθήκης είναι μια αντίδραση που αποτελείται από δύο στάδια. Το δεύτερο βήμα, που είναι η προσθήκη πυρηνόφιλων ή πλούσιων σε ηλεκτρόνια ειδών ή ειδών που αγαπούν τον πυρήνα, είναι ακριβώς το ίδιο με την αντίδραση SN1. Το παρακάτω σχήμα δείχνει την αντίδραση που λαμβάνει χώρα εδώ :-

Έτσι, η ηλεκτρόφιλη προσθήκη έχει ως αποτέλεσμα τον σχηματισμό κορεσμένων ενώσεων.
Συμπέρασμα
Οι αντιδράσεις που περιλαμβάνουν τη χρήση ηλεκτρόφιλων ή την εργασία με βάση τα ηλεκτρόφιλα είναι αντιδράσεις ηλεκτρόφιλης προσθήκης. Καθώς η αντίδραση δεν λαμβάνει χώρα χωρίς ένα ηλεκτρόφιλο ή ηλεκτρόνιο είδος, η ονομασία ηλεκτροφιλική αντίδραση δίνεται σε αυτόν τον τύπο προσθήκης. Υπάρχει μια μεγάλη ποικιλία από χρήσιμες οργανικές ενώσεις που μπορούν να συντεθούν εύκολα με τη βοήθεια αυτής της αντίδρασης. Υπάρχουν δύο στάδια που εμπλέκονται σε αυτόν τον τύπο αντίδρασης—το πρώτο βήμα είναι η επίθεση του ηλεκτρόφιλου και το δεύτερο βήμα είναι η επίθεση ενός πυρηνόφιλου ή ενός είδους που αγαπά τον πυρήνα αφού σχηματίζεται ένα ενδιάμεσο καρβοκατιόν.