Διαφορά μεταξύ μορίου στοιχείου και ένωσης
Κύρια διαφορά – Στοιχείο vs μόριο vs ένωση
Οι όροι στοιχείο, μόριο και ένωση έχουν διαφορετικούς ορισμούς και ιδιότητες όπως αναλύονται παρακάτω σε αυτό το άρθρο. Αν και συχνά χρησιμοποιούμε τον όρο ένωση για να ονομάσουμε οποιοδήποτε μόριο, δεν είναι όλες οι ενώσεις μόνο μόρια. Υπάρχουν πολλά άλλα χημικά είδη που μπορούμε να ονομάσουμε ένωση. Στοιχείο είναι μια ουσία που δεν μπορεί να διασπαστεί περαιτέρω με χημικά μέσα. Ένα μόριο είναι μια ουσία που αποτελείται από δύο ή περισσότερα άτομα που συνδέονται μέσω χημικών δεσμών. Μια ένωση είναι ένα μόριο που αποτελείται από διαφορετικούς τύπους ατόμων που συνδέονται μέσω χημικών δεσμών. Επομένως, μια ένωση είναι επίσης ένας τύπος μορίου, αλλά δεν είναι το ίδιο. Η κύρια διαφορά μεταξύ στοιχείου, μορίου και ένωσης είναι ότι ένα στοιχείο είναι μια ουσία που δεν μπορεί να διαιρεθεί περαιτέρω σε μέρη με χημικά μέσα, ενώ ένα μόριο είναι μια ουσία που μπορεί να διαιρεθεί περαιτέρω σε μέρη με χημικά μέσα και μια ένωση είναι επίσης ένας τύπος μορίου αλλά αποτελείται από διαφορετικούς τύπους μορίων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα Στοιχείο
– Ορισμός, Περιοδικός Πίνακας, Δραστικότητα, Ισότοπα
2. Τι είναι ένα Μόριο
– Ορισμός, Χημικός τύπος, Διαφορετικοί τύποι
3. Τι είναι Σύνθετο
– Ορισμός, διαφορετικοί τύποι
4. Ποια είναι η σχέση μεταξύ του μορίου του στοιχείου και της ένωσης
5. Ποια είναι η διαφορά μεταξύ μορίου στοιχείου και ένωσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:άτομο, ατομικός αριθμός, στοιχείο, χημικός δεσμός, ένωση, ομοιοπολικός δεσμός, διαμόρφωση ηλεκτρονίων, ιονικός δεσμός, αριθμός μάζας, μόριο

Τι είναι ένα στοιχείο
Χημικό στοιχείο είναι μια ουσία που δεν μπορεί να διασπαστεί με χημικά μέσα. Πολλά διαφορετικά χημικά στοιχεία έχουν ανακαλυφθεί μέχρι στιγμής. Έχουν μια μοναδική ιδιότητα, δηλαδή τον αριθμό των πρωτονίων στον πυρήνα. Αυτό ονομάζεται ατομικός αριθμός. Ο ατομικός αριθμός ενός στοιχείου είναι μια σταθερή τιμή για ένα συγκεκριμένο στοιχείο. Δύο στοιχεία δεν μπορούν να έχουν τον ίδιο ατομικό αριθμό. Οποιαδήποτε αλλαγή στον ατομικό αριθμό αλλάζει το στοιχείο. Ωστόσο, τα στοιχεία μπορούν να αλλάξουν μέσω πυρηνικών αντιδράσεων.
Περιοδικός Πίνακας
Τα χημικά στοιχεία ταξινομούνται στον περιοδικό πίνακα των στοιχείων με βάση τον ατομικό τους αριθμό και τη διαμόρφωση των ηλεκτρονίων. Ένα χημικό στοιχείο μπορεί επίσης να εξηγηθεί ως ένα είδος ατόμων ή μια ομάδα ατόμων. Αυτό συμβαίνει επειδή τα άτομα που μπορούν να βρεθούν οπουδήποτε ανήκουν σε ένα συγκεκριμένο χημικό στοιχείο. Αυτό συμβαίνει λόγω της μοναδικότητας του ατομικού αριθμού για ένα συγκεκριμένο χημικό στοιχείο.
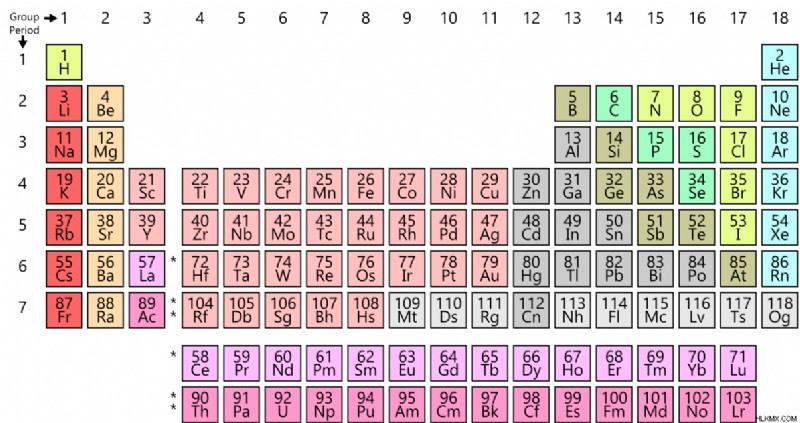
Εικόνα 1:Περιοδικός Πίνακας Στοιχείων
Στον περιοδικό πίνακα στοιχείων, υπάρχουν διαφορετικές κατηγορίες χημικών στοιχείων. Μερικές από τις ταξινομήσεις φαίνονται παρακάτω.
- Μέταλλα, αμέταλλα και μεταλλοειδή
- στοιχεία μπλοκ, στοιχεία μπλοκ p, στοιχεία μπλοκ d και στοιχεία μπλοκ f.
- Μέταλλα αλκαλίων, μέταλλα αλκαλικών γαιών, μέταλλα μετάπτωσης.
- Αλογόνα, ευγενή αέρια, κ.λπ.
Αντιδραστικότητα
Μερικά χημικά στοιχεία είναι αδρανή. μερικά είναι λιγότερο αντιδραστικά ενώ κάποια είναι πολύ αντιδραστικά. Τα αδρανή χημικά στοιχεία περιλαμβάνουν την ομάδα των ευγενών αερίων. Όλα τα άλλα στοιχεία μπορούν εύκολα να υποστούν χημικές αντιδράσεις. Αυτό οφείλεται στο γεγονός ότι δεν έχουν ελλιπή κελύφη ηλεκτρονίων σύμφωνα με τη διαμόρφωση ηλεκτρονίων των ευγενών αερίων και επομένως είναι πολύ σταθερά ως μεμονωμένα άτομα. Δεν έχουν λόγο να αντιδράσουν με άλλα στοιχεία. Αλλά τα άλλα χημικά στοιχεία έχουν ελλιπείς διαμορφώσεις ηλεκτρονίων. Επομένως, υφίστανται διαφορετικές χημικές αντιδράσεις προκειμένου να γεμίσουν τα ηλεκτρονιακά τους κελύφη. Τα λιγότερο αντιδραστικά χημικά στοιχεία έχουν μερικώς γεμάτες, αλλά σταθερές διαμορφώσεις ηλεκτρονίων.

Εικόνα 2:Σειρά Metal Activity
Ισότοπα
Μερικά χημικά στοιχεία είναι εξαιρετικά ραδιενεργά καθώς είναι εξαιρετικά ασταθή. Διασπώνται με την πάροδο του χρόνου μέχρι να αποκτήσουν μια σταθερή κατάσταση. Ορισμένα χημικά στοιχεία έχουν διαφορετικές μορφές γνωστές ως ισότοπα. Τα ισότοπα ενός συγκεκριμένου χημικού στοιχείου έχουν τον ίδιο ατομικό αριθμό αλλά διαφορετικό μαζικό αριθμό. Αυτό σημαίνει ότι ο αριθμός των πρωτονίων στους πυρήνες τους είναι ο ίδιος. Ως εκ τούτου, ανήκουν στο ίδιο χημικό στοιχείο. Αλλά ο αριθμός των νετρονίων στους πυρήνες είναι διαφορετικός μεταξύ τους.
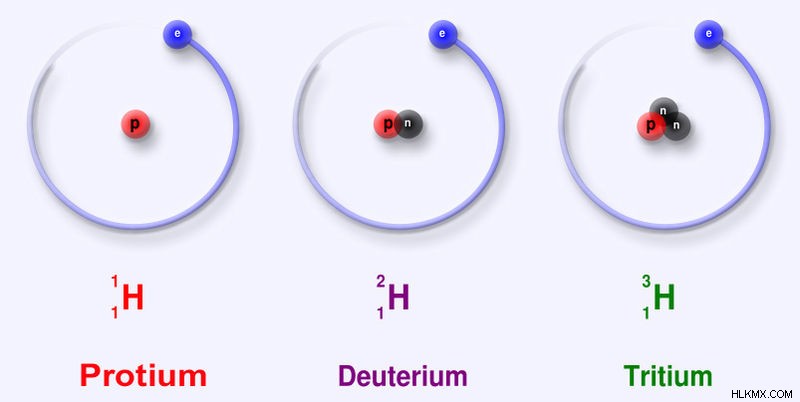
Εικόνα 3:Ισότοπα του χημικού στοιχείου υδρογόνου
Υπάρχουν ονόματα και σύμβολα που χρησιμοποιούνται για την ονομασία κάθε στοιχείου. Τα περισσότερα από αυτά τα ονόματα είναι λατινικές λέξεις και τα σύμβολα προέρχονται ανάλογα.
Τι είναι ένα μόριο
Ένα μόριο είναι μια ομάδα δύο ή περισσότερων ατόμων που συνδέονται χημικά μεταξύ τους και είναι ουδέτερο. Ένα μόριο μπορεί να περιέχει τα άτομα του ίδιου χημικού στοιχείου ή διαφορετικών χημικών στοιχείων. Ένα μόριο στη χημεία είναι ένα πολυατομικό χημικό είδος με ουδέτερο ηλεκτρικό φορτίο. Τα μόρια μπορούν να κατηγοριοποιηθούν σε διαφορετικές ομάδες ανάλογα με τις χημικές και φυσικές ιδιότητες των μορίων.
Ένα μόριο μπορεί να περιέχει άτομα συνδεδεμένα είτε μέσω ομοιοπολικών δεσμών είτε μέσω ιοντικών δεσμών. Ένας ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται τα ασύζευκτα ηλεκτρόνια τους. Ένας ιοντικός δεσμός είναι μια ηλεκτροστατική έλξη μεταξύ δύο ή περισσότερων ατόμων.
Χημικός τύπος
Η σύσταση των ατόμων σε ένα μόριο δίνεται από τον χημικό τύπο του. Ο εμπειρικός τύπος δίνει την αναλογία μεταξύ των ατόμων. Για παράδειγμα, C3 H6 είναι ο χημικός τύπος του προπενίου. Υπάρχουν τρία άτομα άνθρακα και έξι άτομα υδρογόνου συνδεδεμένα μεταξύ τους. Ο εμπειρικός τύπος για αυτό το μόριο είναι CH2 .
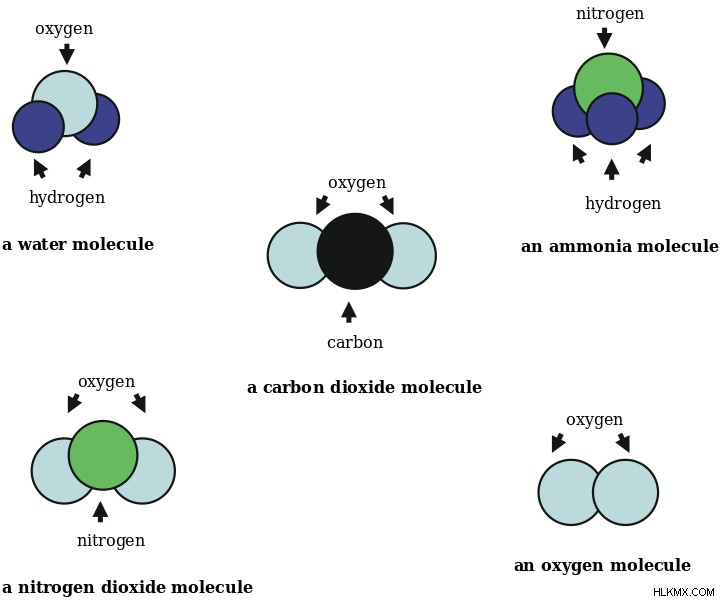
Εικόνα 4:Μερικά κοινά μόρια
Διαφορετικοί τύποι μορίων
- Με βάση τους τύπους ατόμων που υπάρχουν σε ένα μόριο, μπορεί να είναι είτε ομοπυρηνικό είτε ετεροπυρηνικό. Ομοπυρηνικά μόρια αποτελούνται από άτομα του ίδιου στοιχείου. Ετεροπυρηνικά μόρια αποτελούνται από άτομα διαφορετικών χημικών στοιχείων.
- Τα μόρια μπορεί να είναι είτε οργανικά είτε ανόργανα. Οργανικά μόρια αποτελούνται ουσιαστικά από C,H μαζί με κάποια άλλα στοιχεία. Ανόργανα μόρια μπορεί να έχει διαφορετικούς συνδυασμούς διαφορετικών χημικών στοιχείων.
- Αριθμός ατόμων ανά μόριο:διατομικό μόρια, τριατομικά μόρια, πολυατομικά μόρια .
- Τα μόρια που αποτελούνται μόνο από ομοιοπολικό δεσμό είναι ομοιοπολικό μόριο , και τα μόρια που περιέχουν ιονικούς δεσμούς είναι ιονικά μόρια .
- Σύμφωνα με τη γεωμετρία, τα μόρια μπορεί να είναι είτε συμμετρικά είτε ασύμμετρα μόριο . Για παράδειγμα, η γραμμική γεωμετρία του CO2 το κάνει συμμετρικό μόριο.
Ομοίως, υπάρχουν πολλοί τύποι μορίων που μπορούν να βρεθούν στη φύση. Έχουν διαφορετικές αφθονίες. Τα μεμονωμένα άτομα δεν είναι μόρια. Για παράδειγμα, το Ήλιο (Αυτός) δεν είναι μόριο.
Τι είναι μια Σύνθετη
Ένωση είναι ένα χημικό είδος που σχηματίζεται όταν δύο ή περισσότερα άτομα ενώνονται μεταξύ τους χημικά, με ομοιοπολικούς ή ιοντικούς δεσμούς. Όλες οι ενώσεις είναι μόρια, αλλά δεν είναι όλα τα μόρια ενώσεις. Τα ομοπυρηνικά μόρια δεν είναι ενώσεις. Ως ενώσεις θεωρούνται μόνο τα ετεροπυρηνικά μόρια. Οι ενώσεις μπορούν να ομαδοποιηθούν με διαφορετικούς τρόπους, μόνο μερικές αναφέρονται παρακάτω.

Εικόνα 5:Πρόκειται για μια ομοιοπολική ένωση που περιέχει άτομα διαφορετικών χημικών στοιχείων
Διαφορετικοί τύποι ένωσης
- Με βάση τον αριθμό των ατόμων, οι ενώσεις μπορεί να είναι διατομικές, τριατομικές ή πολυατομικές.
- Με βάση τον τύπο χημικού δεσμού, ομοιοπολικές ενώσεις περιέχουν ομοιοπολικούς δεσμούς και ιονικές ενώσεις περιέχουν ιοντικούς δεσμούς.
- Με βάση την πολυπλοκότητα, ορισμένες ενώσεις είναι απλές ενώσεις ενώ άλλες είναι σύνθετες ενώσεις .
- Με βάση τα συστατικά (κατιόν, ανιόντα, ), οι ενώσεις μπορεί να είναι οργανικές ή ανόργανες ενώσεις. Οργανικές ενώσεις περιλαμβάνουν υδρογονάνθρακες, καρβοξυλικά οξέα, αμίδια, αμίνες, αλκοόλες κ.λπ. Ανόργανες ενώσεις περιλαμβάνουν οξείδια, υδρίδια, αλογονίδια, νιτρώδη, νιτρικά, ανθρακικά κ.λπ.
Σχέση μεταξύ μορίου στοιχείου και ένωσης
- Τα μόρια αποτελούνται από άτομα ίδιων ή διαφορετικών χημικών στοιχείων. Τα μόρια που περιέχουν διαφορετικούς τύπους στοιχείων ονομάζονται ενώσεις.
Διαφορά μεταξύ μορίου στοιχείου και ένωσης
Ορισμός
Στοιχείο: Ένα χημικό στοιχείο είναι μια ουσία που δεν μπορεί να διασπαστεί με χημικά μέσα.
Μόριο: Ένα μόριο είναι μια ομάδα δύο ή περισσότερων ατόμων που συνδέονται χημικά μεταξύ τους.
Σύνθετο: Μια ένωση είναι ένα χημικό είδος που σχηματίζεται όταν δύο ή περισσότερα άτομα ενώνονται χημικά, με ομοιοπολικούς ή ιοντικούς δεσμούς.
Μέλη
Στοιχείο: Υπάρχουν 115 γνωστά χημικά στοιχεία.
Μόριο: Οι ουσίες που αποτελούνται από δύο ή περισσότερα άτομα χημικά συνδεδεμένα μεταξύ τους είναι μόρια.
Σύνθετο: Οι ουσίες που αποτελούνται από δύο ή περισσότερα άτομα διαφορετικών χημικών στοιχείων είναι ενώσεις.
Μοναδικές ιδιότητες
Στοιχείο: Τα χημικά στοιχεία περιέχουν έναν μοναδικό ατομικό αριθμό.
Μόριο: Τα μόρια μπορεί να είναι είτε ομοπυρηνικά είτε ετεροπυρηνικά.
Σύνθετο: Τα ετεροπυρηνικά μόρια είναι ενώσεις.
Χημικό στοιχείο
Στοιχείο: Ένα στοιχείο περιέχει παρόμοια άτομα.
Μόριο: Ένα μόριο μπορεί να έχει άτομα είτε του ίδιου στοιχείου είτε διαφορετικών στοιχείων.
Σύνθετο: Μια ένωση έχει άτομα διαφορετικών στοιχείων.
Χημικός δεσμός
Στοιχείο: Τα άτομα διαφορετικών στοιχείων μπορούν να σχηματίσουν διαφορετικούς τύπους χημικών δεσμών ανάλογα με τις διαμορφώσεις ηλεκτρονίων και τη σταθερότητά τους.
Μόριο: Τα μόρια μπορεί να έχουν είτε ομοιοπολικούς δεσμούς είτε ιοντικούς δεσμούς.
Σύνθετο: Οι ενώσεις μπορεί να έχουν ομοιοπολικούς δεσμούς, ιοντικούς δεσμούς ή μεταλλικούς δεσμούς.
Παραδείγματα
Στοιχείο: Μερικά παραδείγματα για χημικά στοιχεία περιλαμβάνουν οξυγόνο, υδρογόνο, άζωτο, χαλκό, ψευδάργυρο κ.λπ.
Μόριο: Μερικά παραδείγματα για μόρια περιλαμβάνουν το οξυγόνο (O2 ), όζον (O3 ), νερό (H2 O), κ.λπ.
Σύνθετο: Μερικά παραδείγματα για ενώσεις περιλαμβάνουν χλωριούχο νάτριο (NaCl), ανθρακικό ασβέστιο (CaCO3 ), κ.λπ.
Συμπέρασμα
Τα μόρια αποτελούνται από χημικά στοιχεία. Τα μόρια που περιέχουν δύο ή περισσότερα διαφορετικά χημικά στοιχεία είναι γνωστά ως ενώσεις. Η κύρια διαφορά μεταξύ μορίου στοιχείου και ένωσης είναι ότι ένα στοιχείο είναι μια ουσία που δεν μπορεί να διαιρεθεί περαιτέρω σε μέρη με χημικά μέσα, ενώ ένα μόριο είναι μια ουσία που μπορεί να διαιρεθεί περαιτέρω σε μέρη με χημικά μέσα και μια ένωση είναι επίσης ένας τύπος μορίου αλλά αποτελείται από διαφορετικούς τύπους μορίων.




