Διάγραμμα Συντεταγμένων Δεσμών
Οι δεσμοί συντεταγμένων είναι δεσμοί που σχηματίζονται μεταξύ αντικειμένων ή χαρακτηριστικών με συντεταγμένες. Οι συντεταγμένες καθορίζονται από ένα σύνολο αριθμών που υποδεικνύουν τη θέση ενός αντικειμένου ή ενός στοιχείου σε έναν 2D ή 3D χώρο. Οι συντεταγμένες ενός αντικειμένου ή ενός χαρακτηριστικού μπορούν να θεωρηθούν ως η θέση ή η θέση του σε ένα επίπεδο συντεταγμένων ή πλέγμα. Η θέση ή η θέση ενός αντικειμένου ή χαρακτηριστικού στο επίπεδο συντεταγμένων ή στο πλέγμα μπορεί να αναπαρασταθεί από ένα ζεύγος συντεταγμένων.
Αποτελούν αναπόσπαστο μέρος της χημείας και το κλειδί για την κατανόηση της δομής της ύλης, καθώς και των αλληλεπιδράσεών της με το φως, και πολλές άλλες πτυχές του χημικού κόσμου.
Δεσμός συντεταγμένων
Ο πιο κοινός δεσμός συντεταγμένων στην οργανική χημεία είναι ένας απλός δεσμός μεταξύ ενός ατόμου άνθρακα και ενός ατόμου μη μετάλλου, όπως ένα άτομο υδρογόνου.
Οι δεσμοί σε ένα άτομο ονομάζονται δεσμοί συντεταγμένων (ή ομοιοπολικοί δεσμοί), επειδή σχηματίζονται από ένα μόνο ζεύγος ηλεκτρονίων. Αυτός ο τύπος δεσμού είναι ένας κατευθυντικός δεσμός, όπου τα ηλεκτρόνια που σχηματίζουν τον δεσμό βρίσκονται σε δύο διαφορετικούς ατομικούς πυρήνες.
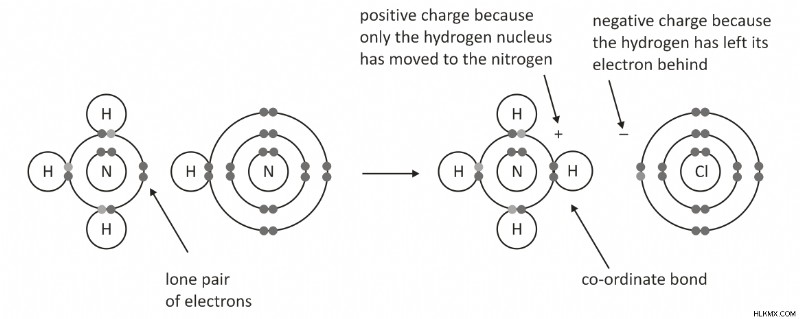
Ένα παράδειγμα δεσμού συντεταγμένων είναι η σχέση μεταξύ ενός ιόντος υδρογόνου και ενός ζεύγους ηλεκτρονίων μεταξύ υδρογόνου και μορίου αμμωνίας όταν το ιόν αμμωνίου σχηματίζεται από τη μεταφορά ενός ιόντος πρωτονίου στο ζεύγος ηλεκτρονίων στο το μόριο αμμωνίου.
Οι δεσμευμένες συντεταγμένες ή οι δοτικοί δεσμοί ορίζονται ως η αλληλεπίδραση σ-δεσμού μεταξύ του ηλεκτραρνητικού ατόμου, (σ είναι η αρχή αποκλεισμού Pauli) και του συστήματος π-ηλεκτρονίων ενός αρωματικού δακτυλίου. Οι δοτικοί δεσμοί υπάρχουν σε μόρια ένωσης όπως το ακετυλένιο και το διοξείδιο του θείου.
Ορισμένες ιδιότητες του δεσμού συντεταγμένων ή του δοτικού δεσμού
Έχουν χαμηλότερα σημεία βρασμού και τήξης από τις ιοντικές ενώσεις.
Όταν τα ηλεκτρόνια μοιράζονται, το κάνουν σε μια συγκεκριμένη κατεύθυνση, και επομένως, είναι κατευθυντικοί δεσμοί.
Ο δεσμός των συντεταγμένων είναι πιο αδύναμος από τον ιοντικό δεσμό.
Ορισμένες από αυτές τις ενώσεις μπορούν να περιγραφούν ότι έχουν ισομερισμό.
Παραδείγματα διαγραμμάτων δεσμών συντεταγμένων
Ιόν αμμωνίου:Στην αμμωνία, το άτομο αζώτου δίνει το ζεύγος ηλεκτρονίων του στο κενό τροχιακό του Η+, επομένως το άζωτο είναι ο δότης και το Η+ είναι ο δέκτης. Ένας δεσμός συντεταγμένων σχηματίζεται μεταξύ Α και Β.
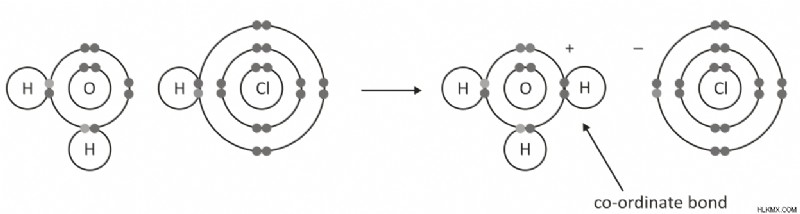
Ιόν υδρονίου:Το ιόν υδρονίου είναι μια χημική ένωση με μοριακό τύπο H3O+. Είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου, αλλά συχνά συναντάται ως το υδροξείδιο του άλατος (ένα κατιόν οξέος [H+]), OH-, επίσης γνωστό ως ανιόν υδροξειδίου, -OH. Το ιόν υδρονίου είναι η ιοντική μορφή του υδρογόνου, η οποία είναι η πιο κοινή μορφή του στοιχείου στη Γη. Όταν μια χημική ουσία χάνει το νερό της, μετατρέπεται σε ιόν υδρονίου.
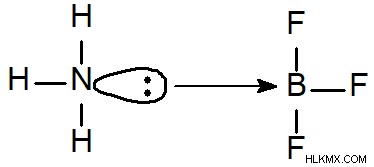
Τριφθοριούχο βόριο αμμωνίας:Το τριφθοριούχο βόριο αμμωνίας είναι ένα άχρωμο έως λευκό αέριο σε θερμοκρασία και πίεση δωματίου. Είναι μια από τις πιο δραστικές ενώσεις μη φθορίου που είναι γνωστές και είναι διαβρωτικό για τα περισσότερα υλικά. Είναι ένα ισχυρό αέριο του θερμοκηπίου και είναι επίσης ένα εξαιρετικά ισχυρό οξειδωτικό και εκρηκτικό. Το τριφθοριούχο βόριο αμμωνίας χρησιμοποιείται κυρίως ως καθαριστικό και απολιπαντικό και για την παρασκευή άλλων χημικών ουσιών.
Συμπέρασμα
Οι δεσμοί συντεταγμένων υπάρχουν σε χημικές αντιδράσεις όπως αυτές που βρίσκονται στο σχηματισμό οξέων, βάσεων και αλάτων. Αυτοί οι δεσμοί σχηματίζονται όταν ένα άτομο μετάλλου έχει ένα τυπικό φορτίο σε έναν τετραεδρικό συντονισμό που το περιβάλλει. Το άτομο μετάλλου βρίσκεται στο κέντρο του συντονισμού. Τα μέταλλα είναι συνήθως τα ίδια μέταλλα με τα γειτονικά τους σε άλλους χημικούς δεσμούς, αλλά αυτό δεν συμβαίνει πάντα.




