Διάσπαση δεσμού άνθρακα
Σύμφωνα με τα διαγράμματα ενεργειακών προφίλ στη χημική κινητική, οι μεταβατικές καταστάσεις αντιπροσωπεύουν τα μέγιστα της ενέργειας. Ενώ τα ενδιάμεσα της αντίδρασης αντιπροσωπεύουν τα ελάχιστα της ενέργειας στο διάγραμμα ενεργειακών προφίλ. Τα ενδιάμεσα της αντίδρασης είναι κάπως σταθερά είδη (σε σύγκριση με μεταβατικές καταστάσεις) που είναι αρκετά σταθερά για να παρατηρηθούν, να αναλυθούν και να μελετηθούν. Αυτά τα ενδιάμεσα της αντίδρασης σχηματίζονται λόγω της διάσπασης του δεσμού άνθρακα είτε με σχάση ομολυτικού δεσμού είτε με σχάση ετερολυτικού δεσμού. Γενικά, κάθε φορά που ένας δεσμός σπάει, σχηματίζεται ένα ενδιάμεσο αντίδρασης. Η διάσπαση του δεσμού των ατόμων άνθρακα ενός μορίου δίνει την ευκαιρία για σχηματισμό νέων δεσμών.
Ομολυτική διάσπαση
Ο ορισμός της ομολυτικής διάσπασης μπορεί να συναχθεί από το ίδιο το όνομα. «Homo» σημαίνει «ίδιο». Όταν ένας δεσμός σπάει με ομολυτική διάσπαση ή ομολυτική διάσπαση δεσμού, τα ηλεκτρόνια που συμμετέχουν στο σχηματισμό ομοιοπολικού δεσμού κατανέμονται εξίσου και στα δύο συστατικά άτομα άνθρακα. Αυτή η ίση κατανομή ηλεκτρονίων και στα δύο άτομα οδηγεί στο σχηματισμό αφόρτιστων ειδών που έχουν επτά ηλεκτρόνια που ονομάζονται ρίζες ή ελεύθερες ρίζες. Οι ελεύθερες ρίζες άνθρακα είναι ενδιάμεσα αντιδράσεων πολλών αντιδράσεων όπως η αλογόνωση παρουσία ορατού φωτός, ο πολυμερισμός αλκενίων κ.λπ. Απαιτείται ενέργεια με τη μορφή θερμότητας ή φωτός για την έναρξη της διαδικασίας διάσπασης του δεσμού άνθρακα. Η ομολυτική διάσπαση του δεσμού άνθρακα αντιπροσωπεύεται από ένα βέλος με μισή κεφαλή. επίσης γνωστό ως βέλος κεφαλής ψαριού και κάθε άτομο άνθρακα στην πλευρά του προϊόντος αντιπροσωπεύεται με ένα μόνο μη ζευγαρωμένο ηλεκτρόνιο. Αυτά τα βέλη δείχνουν την κίνηση των ηλεκτρονίων μετά τη διάσπαση του δεσμού άνθρακα. Η ομόλυση ή η διάσπαση ομολυτικού δεσμού συμβαίνει συχνότερα σε μη πολικούς δεσμούς.
 Ετερολυτική διάσπαση
Ετερολυτική διάσπαση
Ο ορισμός της ετερολυτικής διάσπασης μπορεί επίσης να συναχθεί από το ίδιο το όνομα. «Hetero» σημαίνει «διαφορετικό». Όταν ένας δεσμός σπάει με ετερολυτική διάσπαση ή ετερολυτική διάσπαση δεσμού, τα ηλεκτρόνια που συμμετέχουν στο σχηματισμό ομοιοπολικού δεσμού κατανέμονται άνισα και στα δύο συστατικά άτομα άνθρακα. Αυτή η άνιση κατανομή ηλεκτρονίων και στα δύο άτομα οδηγεί στο σχηματισμό φορτισμένων ειδών που ονομάζονται καρβοκατιόντα και καρβανιόντα. Τα καρβοκατιόντα είναι θετικά φορτισμένα είδη που έχουν έξι ηλεκτρόνια. Τα καρβανιόντα είναι αρνητικά φορτισμένα είδη που έχουν οκτώ ηλεκτρόνια. Τα καρβοκατιόντα είναι ενδιάμεσα αντιδράσεων πολλών αντιδράσεων όπως πυρηνόφιλες αντιδράσεις υποκατάστασης, αντίδραση προσθήκης αλκενίων, υδροβορίωση και οξείδωση, πολλές αναδιατάξεις κ.λπ. , κ.λπ. Η ετερολυτική διάσπαση του δεσμού άνθρακα αντιπροσωπεύεται από ένα βέλος με πλήρη κεφαλή. γνωστό και ως βέλος διπλής ακμής και τα άτομα άνθρακα στην πλευρά του προϊόντος αντιπροσωπεύονται ως αλλαγμένα είδη με θετικό και αρνητικό φορτίο. Τα βέλη δείχνουν την κίνηση των ηλεκτρονίων μετά τη διάσπαση του δεσμού άνθρακα.
 Άνοιγμα κουδουνίσματος
Άνοιγμα κουδουνίσματος
Μια αντίδραση που περιλαμβάνει το άνοιγμα ενός δακτυλίου συνήθως λαμβάνει χώρα μέσω ετερολυτικής διάσπασης ή ετερολύσεως. Τα συστατικά άτομα που συνδέονται με τη θέση της ετερολυτικής σύντηξης δεν αποσπώνται πλήρως από το μόριο, δηλαδή το μόριο παραμένει ως μια ενιαία μονάδα.
Παραδείγματα διάσπασης του δεσμού άνθρακα
Παραδείγματα ομολυτικής διάσπασης του δεσμού άνθρακα-
Προσθήκη ελεύθερων ριζών στα αλκένια
Στην προσθήκη ελεύθερων ριζών σε ένα αλκένιο, μια ελεύθερη ρίζα προστίθεται στο αλκένιο για να σχηματίσει νέους δεσμούς άνθρακα και να παράγει αλκάνια. Στο δεδομένο παράδειγμα, ο δεσμός υπεροξειδίου υφίσταται ομολυτική διάσπαση και δημιουργεί δύο μόρια ελεύθερων ριζών οξυγόνου. Αυτή η ελεύθερη ρίζα αντιδρά με ένα αλκένιο και μια ρίζα ελεύθερη άνθρακα παράγεται κατά τη διάρκεια της αντίδρασης. Η πρόσφατα παραγόμενη ελεύθερη ρίζα άνθρακα αντιδρά με ένα άλλο μόριο αλκενίου. Στο τελικό στάδιο της αντίδρασης δεν παραμένει καμία ελεύθερη ρίζα. 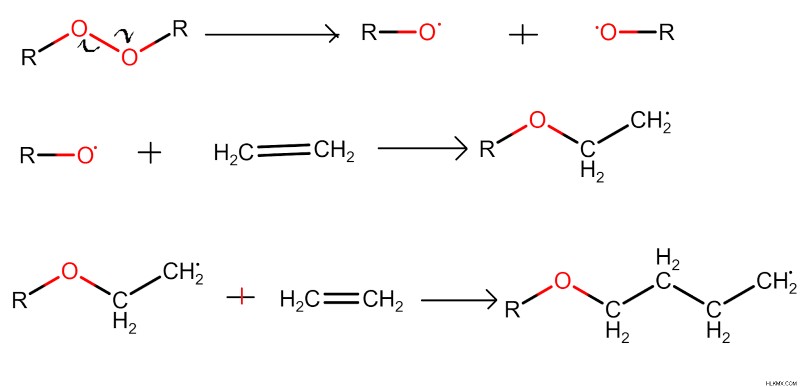
Αλογόνωση
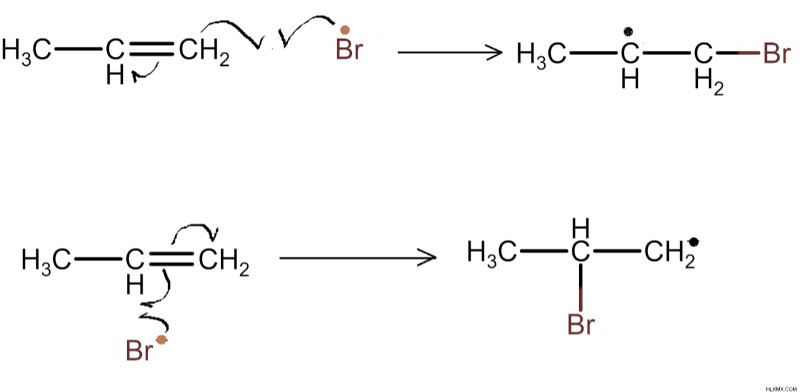
Ο ακόρεστος δεσμός του αλκενίου υφίσταται ομολυτική διάσπαση και αντιδρά με την ελεύθερη ρίζα βρωμίου. Αυτό ξεκινά την αντίδραση του άνθρακα με ελεύθερες ρίζες. Στο τελικό στάδιο της αντίδρασης δεν παραμένει καμία ελεύθερη ρίζα.
Παραδείγματα ομολυτικής διάσπασης δεσμού άνθρακα-
Πυρηνόφιλες αντιδράσεις υποκατάστασης
Οι αντιδράσεις μονομοριακής πυρηνόφιλης υποκατάστασης ή αντιδράσεις SN1 είναι πολύ αργές αντιδράσεις. Το στάδιο στο οποίο σχηματίζεται το ενδιάμεσο καρβοκατιόν είναι το στάδιο προσδιορισμού της ταχύτητας της αντίδρασης. Ο σχηματισμός του καρβοκατιόντος διευκολύνει την αναστροφή των προϊόντων. Ο σχηματισμός του καρβοκατιόντος λαμβάνει χώρα όταν η αποχωρούσα ομάδα χαθεί από την τοποθεσία.
Στη δεδομένη αντίδραση, η αποχωρούσα ομάδα αποσπάται από τον άνθρακα με διάσπαση ετερολυτικού δεσμού ή ετερολυτική σχάση δεσμού αφήνοντας πίσω ένα ενδιάμεσο καρβοκατιόν 6 ηλεκτρονίων υψηλής αντίδρασης. Λόγω της παρουσίας του ενδιάμεσου καρβοκατιόντος, λαμβάνει χώρα αναστροφή και το εισερχόμενο πυρηνόφιλο προσκολλάται στην αντίθετη πλευρά. 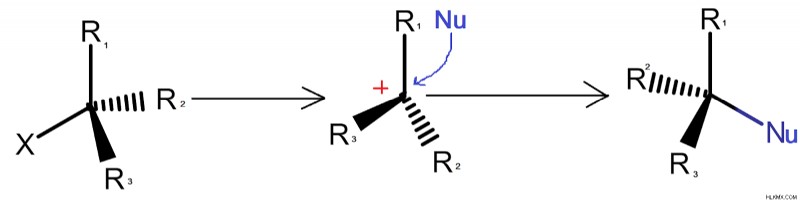
Αποκαρβοξυλίωση
Στην αποκαρβοξυλίωση, σχηματίζεται ένα ενδιάμεσο καρβανιόν στην πορεία της αντίδρασης. Ο δεσμός μεταξύ του άνθρακα της αλκυλομάδας και της καρβονυλομάδας υφίσταται ετερολυτική διάσπαση ή ετερολυτική σχάση δεσμού. Η ομάδα αλκυλίου αποκτά ένα ηλεκτρόνιο και έτσι γίνεται ένα αρνητικά φορτισμένο είδος. Ο άνθρακας της ομάδας καρβονυλίου σχηματίζει έναν δεσμό pi με το οξυγόνο για να αποκτήσει σταθερότητα και να παράγει διοξείδιο του άνθρακα. 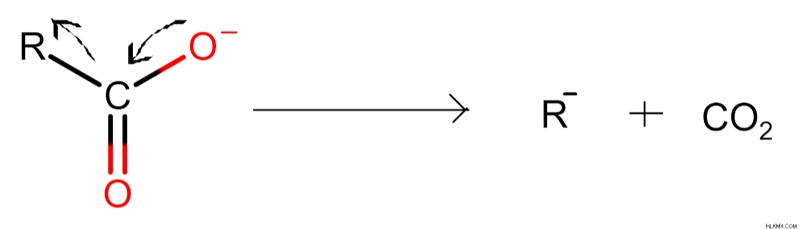
Συμπέρασμα
Η διάσπαση των δεσμών άνθρακα είναι ότι χωρίς τη διάσπαση προηγούμενων δεσμών δεν μπορούν να σχηματιστούν νέοι δεσμοί. Για να σχηματιστούν καλύτεροι και ισχυρότεροι δεσμοί, οι παλιοί δεσμοί πρέπει να σπάσουν για να δημιουργηθεί ένα πιο σταθερό μόριο. Η διάσπαση του δεσμού άνθρακα συμβαίνει είτε μέσω σχάσης ετερολυτικού δεσμού είτε μέσω σχάσης ομολυτικών δεσμών. Η διάσπαση των δεσμών άνθρακα παράγει είδη υψηλής αντίδρασης που ονομάζονται ενδιάμεσα αντίδρασης όπως καρβοκατιόντα, καρβανιόντα και ρίζες ελεύθερες άνθρακα. Αυτά τα είδη αντιδρούν με άλλα είδη ή άτομα για να σχηματίσουν νέους δεσμούς. Η διάσπαση δεσμών άνθρακα και ο σχηματισμός νέων δεσμών είναι η πιο βασική αρχή της χημείας.




