ClF3 Μοριακή Γεωμετρία και Γωνίες Δεσμών
Ο χημικός δεσμός είναι μια δύναμη στη Φύση που δεσμεύει διάφορα χημικά συστατικά όπως άτομα, ιόντα κ.λπ., μεταξύ τους. Οι χημικοί δεσμοί σχηματίζονται για να αποκτήσουν σταθερότητα με απελευθέρωση ενέργειας.
Ο υβριδισμός είναι μια διαδικασία ανάμειξης ατομικών τροχιακών για να σχηματιστούν νέα υβριδικά τροχιακά που έχουν διαφορετικές ενέργειες και σχήματα από τα ατομικά τροχιακά που είναι κατάλληλα για το ζευγάρωμα ηλεκτρονίων για το σχηματισμό χημικών δεσμών στη θεωρία των δεσμών σθένους.
Γωνία δεσμού
Μια γωνία δεσμού είναι μια γεωμετρική γωνία μεταξύ δύο γειτονικών δεσμών. Ως γωνία δεσμού ορίζεται η γωνία μεταξύ των γραμμών που αντιπροσωπεύουν τα τροχιακά που περιέχουν τα συνδετικά ηλεκτρόνια. Βοηθά στον προσδιορισμό του σχήματος και μπορεί να εκφραστεί σε μοίρες.
Υβριδισμός
Ο υβριδισμός είναι η διαδικασία ανάμειξης τροχιακών που έχουν ελαφρώς διαφορετικές ενέργειες προκειμένου να ανακατανεμηθούν οι ενέργειές τους, με αποτέλεσμα το σχηματισμό ενός νέου συνόλου τροχιακών ισοδύναμων ενεργειών και σχημάτων.
Δυνατότητες υβριδισμού
(i) Τροχιακά που έχουν σχεδόν ίση ενέργεια συμμετέχουν στον υβριδισμό.
(ii) Ο αριθμός των ατομικών τροχιακών που αναμειγνύονται ισούται με τον αριθμό των υβριδικών τροχιακών που παράγονται.
(iii) Ο υβριδισμός μπορεί να υποδεικνύει τη γεωμετρία ενός ομοιοπολικού μορίου.
(iv) Τα υβριδικά τροχιακά μπορούν να σχηματίσουν πιο αποτελεσματικούς δεσμούς από τα καθαρά ατομικά τροχιακά.
Απαραίτητες συνθήκες για υβριδισμό:
(i) Τα τροχιακά κελύφους σθένους συμμετέχουν στον υβριδισμό.
(ii) Τα τροχιακά που εμπλέκονται στον υβριδισμό πρέπει να έχουν σχεδόν ίση ενέργεια.
(iii) Στον υβριδισμό, η προώθηση ηλεκτρονίων δεν είναι απαραίτητη προϋπόθεση.
(iv) Σε ορισμένες περιπτώσεις, γεμάτα τροχιακά κελύφους σθένους συμμετέχουν επίσης στον υβριδισμό.
Θεωρία απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους (VSEPR)
Αυτή η θεωρία λέει ότι:
1. Ο αριθμός των ζευγών ηλεκτρονίων που βρίσκονται στο κέλυφος σθένους του κεντρικού ατόμου καθορίζει τη γεωμετρία διαφόρων μορίων και ιόντων.
2. Τα ζεύγη ηλεκτρονίων προσπαθούν να μείνουν όσο το δυνατόν πιο μακριά για να αποκτήσουν μια ελάχιστη απωστική κατάσταση.
3. Όταν παρόμοια άτομα μόνο των συνδεδεμένων ζευγών ηλεκτρονίων περιβάλλουν το κεντρικό άτομο, οι απωστικές αλληλεπιδράσεις είναι πανομοιότυπες και η μοριακή γεωμετρία είναι κανονική.
4. Όταν μόνο τα συνδεδεμένα ζεύγη ηλεκτρονίων ανόμοιων ατόμων περιβάλλουν το κεντρικό άτομο, οι απωστικές αλληλεπιδράσεις δεν είναι ισοδύναμες. Ως εκ τούτου, η γεωμετρία του μορίου δεν θα είναι κανονική.
5. Όταν και τα δύο συνδεδεμένα ζεύγη (bp) και τα μεμονωμένα ζεύγη ηλεκτρονίων (lp) περιβάλλουν το κεντρικό άτομο, οι απωστικές αλληλεπιδράσεις δεν είναι ισοδύναμες. Ως εκ τούτου, η γεωμετρία του μορίου θα είναι ακανόνιστη.
Οι απωθητικές αλληλεπιδράσεις μειώνονται με τη σειρά:
μοναχικό ζεύγος-δεσμός <ζεύγος ομολόγων-ζεύγος ομολόγων <μοναχικό ζεύγος – μοναχικό ζεύγος
Ο υβριδισμός του τριφθοριούχου χλωρίου
Για να μάθουμε για τη μοριακή γεωμετρία και τη γωνία δεσμού του τριφθοριούχου χλωρίου, πρέπει να συζητήσουμε τον υβριδισμό του. Όταν μιλάμε για τον υβριδισμό του τριφθοριούχου χλωρίου, πρέπει να λάβουμε υπόψη το κεντρικό του άτομο, το χλώριο. Το κεντρικό άτομο περιέχει 7 ηλεκτρόνια σθένους, ενώ το ClF3 αποτελείται από 3 ζεύγη δεσμών και 2 μεμονωμένα ζεύγη. Η ηλεκτρονική διαμόρφωση κελύφους σθένους του Cl δίνεται ως 3s2, 3px2, 3py2, 3pz1, 3d.
Όταν το χλώριο συνδυάζεται με άτομα φθορίου για να σχηματίσει το ClF3, απαιτούνται τρία ασύζευκτα ηλεκτρόνια για να δημιουργηθεί ένας δεσμός με τρία άτομα F. Ένα ζευγαρωμένο ηλεκτρόνιο Cl στο 3p υποκέλυφος παραμένει ως μοναχικό ζεύγος ή ασύζευκτο.
Σαν αποτέλεσμα, κατά τη διάρκεια του υβριδισμού, ένα 3s, τρία 3p και ένα από τα 3d τροχιακά συμμετέχουν σε αυτή τη διαδικασία, η οποία οδηγεί στον σχηματισμό πέντε υβριδικών τροχιακών sp3d. Τώρα, δύο υβριδικά τροχιακά θα περιέχουν ένα ζεύγος ηλεκτρονίων και τρία υβρίδια θα έχουν ασύζευκτα ηλεκτρόνια, τα οποία θα επικαλύπτονται με το τροχιακό 2p του F για να σχηματίσουν απλούς δεσμούς.
Το κεντρικό άτομο του χλωρίου απαιτεί τρία ασύζευκτα ηλεκτρόνια για να συνδεθεί με τρία άτομα F.
Το ClF3 αποτελείται πλέον από 3 ζεύγη δεσμών και 2 μοναχικά ζεύγη.
Όταν ένα 3s, τρία 3p και ένα από τα τρισδιάστατα τροχιακά του χλωρίου συμμετέχουν στον υβριδισμό, τότε σχηματίζονται πέντε υβριδικά τροχιακά sp3d.
Μοριακή Γεωμετρία
Η μοριακή γεωμετρία, γνωστή και ως μοριακή δομή, είναι η τρισδιάστατη δομή ή διάταξη των ατόμων σε ένα μόριο. Ας συζητήσουμε τη μοριακή γεωμετρία και τη γωνία δεσμού του τριφθοριούχου χλωρίου.
Μοριακή γεωμετρία ClF3 και γωνίες δεσμών
Η δομή του τριφθοριούχου χλωρίου αποτελείται από ένα άτομο χλωρίου που περιβάλλεται από τρία άτομα φθορίου. Στη δομή του, υπάρχουν δύο μεμονωμένα ζεύγη ηλεκτρονίων συνδεδεμένα με το κεντρικό άτομο χλωρίου. Το άτομο χλωρίου σχηματίζει τρεις ομοιοπολικούς δεσμούς με τα γύρω του άτομα φθορίου σε σταθερή κατάσταση. Ο υβριδισμός του κεντρικού ατόμου χλωρίου είναι sp3d.
Η μοριακή γεωμετρία του ClF3 λέγεται ότι έχει σχήμα Τ. Το ClF3 αποκτά τέτοιο σχήμα επειδή δύο μόνα ζεύγη καταλαμβάνουν θέσεις του ισημερινού καθώς απαιτούν περισσότερο χώρο και μεγαλύτερες απωθήσεις. Είναι διατεταγμένα σε τριγωνικό διπυραμιδικό σχήμα με 3 δεσμούς και 2 μοναχικά ζεύγη. Υπάρχει επίσης μια ασύμμετρη κατανομή φορτίου που βρίσκεται γύρω από το κεντρικό άτομο.
Η μοριακή γεωμετρία και η γωνία δεσμού του τριφθοριούχου χλωρίου είναι τριγωνική διπυραμιδική με γωνία δεσμού F-Cl-F 175°.
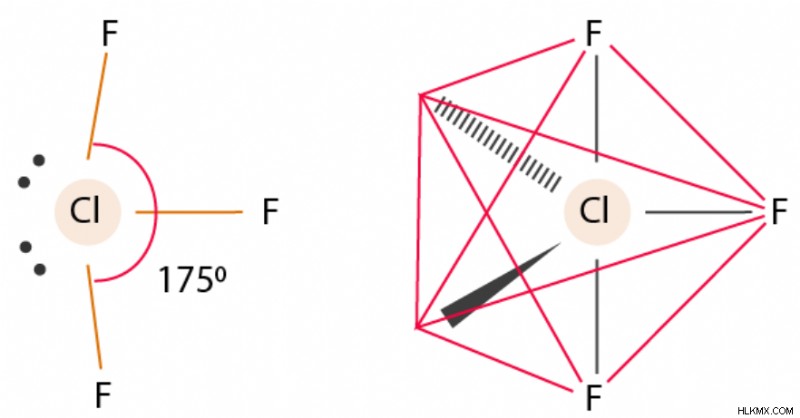
Συμπέρασμα
Οι χημικοί δεσμοί σχηματίζονται όταν τα ηλεκτρόνια διαφορετικών ατόμων αλληλεπιδρούν για να δημιουργήσουν μια πιο σταθερή διάταξη από ό,τι όταν αυτά τα άτομα είναι χώρια.
Η μοριακή γεωμετρία και η γωνία δεσμού του ClF3 είναι σχήματος Τ, με έναν βραχύ δεσμό 1,598 Α και δύο μακρούς δεσμούς 1,698 Α μαζί με γωνία δεσμού F-Cl-F 175°. Αυτή η δομή επικυρώνει την πρόβλεψη της θεωρίας VSEPR, η οποία λέει ότι μεμονωμένα ζεύγη ηλεκτρονίων καταλαμβάνουν δύο ισημερινές θέσεις μιας υποθετικής τριγωνικής διπυραμίδας.