Ταξινόμηση του καρβοκατιόντος
Τα κατιόντα άνθρακα είναι εξαιρετικά αντιδραστικά και ασταθή λόγω μιας ατελούς οκτάδας, για να αναφέρουμε μερικά χαρακτηριστικά. Τα καρβοκατιόντα, με απλούς όρους, δεν έχουν οκτώ ηλεκτρόνια και επομένως δεν ικανοποιούν τον κανόνα της οκτάδας.
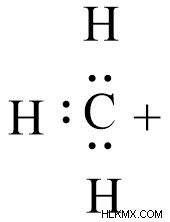
Στο καρβοκατιόν, ο άνθρακας υβριδοποιείται sp2 σχηματίζοντας μια τριγωνική επίπεδη γεωμετρία. Η εξωτερική ηλεκτρονική διαμόρφωση του άνθρακα περιέχει 6 ηλεκτρόνια και το κενό τροχιακό p δείχνει την έλλειψη ηλεκτρονίων. Εξαιτίας αυτού, αναφέρεται ως είδος με έλλειψη ηλεκτρονίων, κοινώς γνωστό ως ηλεκτρόφιλο.
Ένα καρβοκατιόν εμφανίζεται συνήθως σε αντιδράσεις SN1, αντιδράσεις απομάκρυνσης και άλλες χημικές αντιδράσεις.
Ταξινόμηση καρβοκατιόν
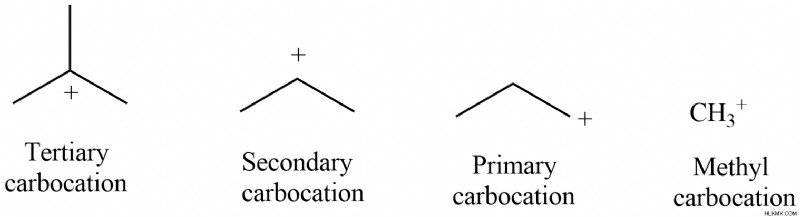
Η ποσότητα των ομάδων άνθρακα που συνδέονται με τον άνθρακα καθορίζει το όνομα του καρβοκατιόντος. Με βάση τον αριθμό των ατόμων άνθρακα που συνδέονται με αυτό, το καρβοκατιόν μπορεί να ταξινομηθεί ως μεθύλιο, πρωτογενές, δευτερογενές ή τριτοταγές:
1. Μεθυλικό καρβοκατιόν:Όταν κανένας άνθρακας δεν συνδέεται με τον θετικά φορτισμένο άνθρακα, αναφέρεται απλώς ως καρβοκατιόν μεθυλίου.
2. Το πρωτογενές καρβοκατιόν, το δευτερεύον καρβοκατιόν και το τριτογενές καρβοκατιόν, αντίστοιχα, σχηματίζονται όταν ένας, δύο ή τρεις άνθρακες συνδέονται με τον άνθρακα με το θετικό φορτίο.
3. Ένα αλλυλικό καρβοκατιόν ορίζεται ως ένας διπλός δεσμός άνθρακα-άνθρακα δίπλα σε άνθρακα με θετικό φορτίο.
4. Ομοίως, εάν ένας θετικά φορτισμένος άνθρακας συνδέεται με διπλό δεσμό, το καρβοκατιόν είναι γνωστό ως βινυλικό καρβοκατιόν. Ο υβριδισμός του θετικού φορτισμένου άνθρακα είναι sp και η γεωμετρία είναι γραμμική.
5. Όταν ο άνθρακας με το θετικό φορτίο βρίσκεται σε έναν δακτύλιο βενζολίου, το καρβοκατιόν ονομάζεται καρβοκατιόν αρυλίου.
6. Ως βενζυλικό καρβοκατιόν ορίζεται ο άνθρακας με θετικό φορτίο που βρίσκεται αμέσως δίπλα σε έναν δακτύλιο βενζολίου.
Απροσδόκητα, υπάρχει ένας άλλος τύπος καρβοκατιόν γνωστό ως πυραμιδικό καρβοκατιόν εκτός από αυτά τα δύο. Τα ιόντα αυτού του τύπου αποτελούνται από ένα μόνο άτομο άνθρακα που προτιμά να αιωρείται πάνω από ένα τετράπλευρο ή πεντάπλευρο πολύγωνο που μοιάζει με πυραμίδα. Το φορτίο στο τετράπλευρο πυραμιδικό ιόν θα είναι +1, ενώ το φορτίο στην πυραμίδα πέντε όψεων θα είναι +2.
Σχηματισμός καρβοκατιόν
Τα καρβοκατιόντα μπορούν να δημιουργηθούν χρησιμοποιώντας μία από τις δύο βασικές διαδικασίες που αναφέρονται παρακάτω:
1. Διάσπαση δεσμού άνθρακα.
2. Ηλεκτρόφιλη προσθήκη
1. Διάσπαση δεσμού άνθρακα
Όταν η σύνδεση μεταξύ του άνθρακα και των ατόμων που είναι συνδεδεμένα σε αυτόν διασπάται, η αποχωρούσα ομάδα αφαιρεί τα κοινά ηλεκτρόνια. Ως αποτέλεσμα, το άτομο άνθρακα είναι φτωχό σε ηλεκτρόνια. Ως εκ τούτου, αναπτύσσεται ένα θετικό φορτίο, με αποτέλεσμα το σχηματισμό ενός καρβοκατιόντος. Όσο χαμηλότερη είναι η τιμή της ενέργειας ενεργοποίησης, τόσο μεγαλύτερη θα είναι η τάση διάσπασης δεσμού ή δημιουργίας ενός πιο σταθερού καρβοκατιόντος.
Ένα καρβοκατιόν δημιουργείται ως ενδιάμεσο αντίδρασης σε πολλές οργανικές αντιδράσεις, όπως οι αντιδράσεις SN1 και E1.
2. Ηλεκτρόφιλη προσθήκη
Ένα ηλεκτρόφιλο προσβάλλει ένα ακόρεστο σημείο (διπλός ή τριπλός δεσμός) σε ηλεκτροφιλική προσθήκη, προκαλώντας τη διάσπαση του δεσμού pi, με αποτέλεσμα την παραγωγή ενός καρβοκατιόντος. Όσο χαμηλότερη είναι η ενέργεια ενεργοποίησης και όσο πιο γρήγορη είναι η προσθήκη, τόσο πιο σταθερά είναι τα καρβοκατιόντα. Η αντίδραση του HBr (ένα ηλεκτρόφιλο) με το προπένιο (CH3CH =CH2) δείχνει ηλεκτροφιλική προσθήκη σε έναν δεσμό pi.
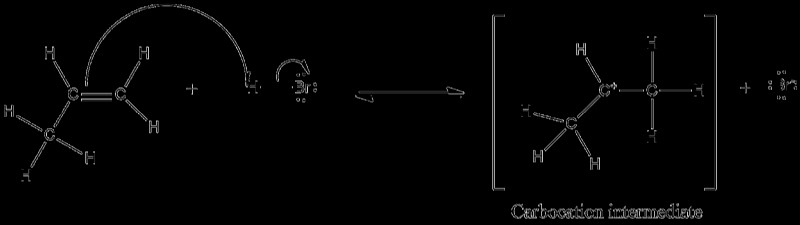
Θα πρέπει να αναφερθεί ότι ο σχηματισμός δευτερογενούς καρβοκατιόντος προτιμάται έναντι του πρωτογενούς σχηματισμού καρβοκατιόντος επειδή το δευτερογενές καρβοκατιόν είναι πιο σταθερό λόγω συντονισμού. Αυτό είναι επίσης σύμφωνο με τον κανόνα του Markovnikov. Τα αλκένια, τα αλκίνια και οι δακτύλιοι βενζολίου είναι όλοι γνωστό ότι υφίστανται ηλεκτροφιλικές αντιδράσεις προσθήκης.
Τα καρβοκατιόντα είναι εξαιρετικά αντιδραστικά λόγω της έλλειψης ηλεκτρονίων, του κενού τροχιακού και της ατελούς οκτάδας τους. Ως αποτέλεσμα, η σταθερότητά του εξαρτάται από την πληρότητα των οκτάδων και τη μείωση της έλλειψης ηλεκτρονίων.
Παραδείγματα σχηματισμού καρβοκατιόντων
Οι ακόλουθες διαδικασίες μπορούν να βοηθήσουν ένα καρβοκατιόν να διατηρήσει τη σταθερότητά του:
1. Πυρηνόφιλη προσθήκη
2. Σχηματισμός δεσμού Pi
3. Αναδιάταξη
1. Πυρηνόφιλη προσθήκη
Ένα καρβοκατιόν είναι μια οκτάδα με ανεπάρκεια ηλεκτρονίων με θετικό φορτίο και ατελές οκτάδα. Η συμπερίληψη ενός πυρηνόφιλου σταθεροποιεί το θετικό φορτίο, με αποτέλεσμα την ανάπτυξη ενός νέου ομοιοπολικού δεσμού. Το καρβοκατιόν σταθεροποιείται ως αποτέλεσμα αυτού. Επειδή το καρβοκατιόν είναι τόσο αντιδραστικό, ακόμη και ένα αδύναμο πυρηνόφιλο μπορεί να συνδεθεί με αυτό. Αυτός είναι ένας πολύ κοινός μηχανισμός σταθεροποίησης του καρβοκατιόντος.
2. Σχηματισμός δεσμού Pi
Για να εξαλείψει το θετικό του φορτίο και να ολοκληρώσει την οκτάδα του, το καρβοκατιόν μπορεί να δεχθεί ηλεκτρόνια από το περιβάλλον υδρογόνο. Μπορεί έτσι να δημιουργηθεί μια νέα σύνδεση pi. Οποιαδήποτε βάση, γενικά, πρέπει να αφαιρεί το άτομο υδρογόνου. Λόγω της υψηλής αντιδραστικότητας των καρβοκατιόντων, ακόμη και μια ασθενής βάση όπως το νερό ή το ιόν ιωδίου μπορεί να βοηθήσει στην αποπρωτονίωση. Όταν λαμβάνει χώρα η αποπρωτονίωση, παράγονται δύο τύποι προϊόντων. Το κύριο προϊόν είναι η πιο σταθερή χημική ουσία.
3. Αναδιάταξη
Το καρβοκατιόν μπορεί να πάρει ηλεκτρόνια από το κοντινό υδρογόνο για να αφαιρέσει το θετικό του φορτίο και να ολοκληρώσει την οκτάδα του. Ως αποτέλεσμα, μπορεί να δημιουργηθεί μια νέα σύνδεση Pi. Γενικά, οποιαδήποτε βάση πρέπει να αφαιρεί το άτομο υδρογόνου. Λόγω της υψηλής αντιδραστικότητας των καρβοκατιόντων, ακόμη και μια αδύναμη βάση όπως το νερό ή το ιόν ιωδίου μπορεί να βοηθήσει στην αποπρωτονίωση. Όταν τα πρωτόνια αποπρωτονιώνονται, παράγονται δύο τύποι προϊόντων. Η χημική ουσία που είναι πιο σταθερή είναι το κύριο προϊόν.
Συμπέρασμα
Ένα καρβοκατιόν πρέπει να διακρίνεται από άλλους τύπους κατιόντων. Έτσι, ένα καρβοκατιόν έχει θετικό φορτίο αφού στερείται ηλεκτρονίων, πράγμα που σημαίνει ότι ο άνθρακας μπορεί να δεχθεί άλλα δύο. Αυτό το διακρίνει ως οξύ Lewis, καθώς και ως καρβοκατιόν από τα άλλα κατιόντα που συνήθως συναντάμε.




