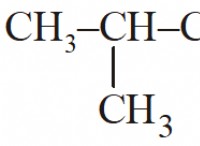Αλκάνιο
Τα αλκάνια, γνωστά και ως παραφίνη, είναι άκυκλοι κορεσμένοι υδρογονάνθρακες. Αυτά αποτελούνται από άτομα άνθρακα και οξυγόνου διατεταγμένα στην ενιαία δομή δέντρου.
Τα αλκάνια είναι ενώσεις που αποτελούνται εξ ολοκλήρου από άτομα άνθρακα και υδρογόνου που συνδέονται μεταξύ τους με απλούς δεσμούς άνθρακα-άνθρακα και απλούς δεσμούς άνθρακα-υδρογόνου.
Τα αλκάνια είναι αδιάλυτα στο νερό, για τα οποία είναι εξαιρετικά πολικά. Τα αλκάνια είναι μια σειρά κορεσμένων υδρογονανθράκων ανοιχτής αλυσίδας.
Τα αλκάνια ορίζονται ως «ακυκλικοί διακλαδισμένοι ή μη διακλαδισμένοι υδρογονάνθρακες» από τη Διεθνή Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC).
Τα άτομα άνθρακα του αλκανίου υβριδίζονται sp3 μαζί με δεσμούς 4 σίγμα. Τα άτομα υδρογόνου ενώνονται με άτομα άνθρακα με έναν μόνο δεσμό.
Οι αλυσίδες αλκανίων δημιουργούνται από έναν γενικό χημικό τύπο. Η γενική ένδειξη για τα αλκάνια είναι CnH2n+2.
Για παράδειγμα ,
n =1 => C1H2(1) +2 =CH4 =μεθάνιο
n =2 =>C2H2(2) +2 =C2H6 =αιθάνιο
n =3 =>C3H2(3)+2 =C3H8 =προπάνιο
Η σειρά των αλκανίων δημιουργείται από τον παραπάνω τύπο. Το «n» αντιπροσωπεύει τον αριθμό των δεσμών που θα κρατήσει ο άνθρακας με το υδρογόνο.
Τα αλκάνια χωρίζονται σε τρεις ομάδες:αλκάνια αλυσίδας, κυκλοαλκάνια και διακλαδισμένα αλκάνια.
Ισομέρεια στα αλκάνια
Ο ισομερισμός προκύπτει όταν υπάρχει μια κατάσταση για μια διάταξη των στοιχείων. Όταν σχηματίζονται αλκάνια με περισσότερα από τρία άτομα άνθρακα, τότε προκύπτει η έννοια της τακτοποίησής τους. Αυτό είναι γνωστό ως ισομερισμός.
Το απλούστερο ισομερές ενός αλκανίου είναι αυτό με ένα μόνο άτομο άνθρακα, π.χ. μεθάνιο. Δεν υπάρχει διακλάδωση των ατόμων άνθρακα, και όλα είναι διατεταγμένα με μία μόνο αλυσίδα. Αυτά τα είδη ισομερών είναι γνωστά ως "n-ισομερή" (το "n" σημαίνει κανονικά, κανονικά ισομερή).
Με την αύξηση του αριθμού των ατόμων άνθρακα, οι αλυσίδες του άνθρακα αυξάνονται, προκαλώντας το σχηματισμό δακτυλίων ή αλυσίδων.
C1 – μεθάνιο, C2 – αιθάνιο, C3 – προπάνιο, C4 – έχει δύο ισομερή – βουτάνιο και ισοβουτάνιο .
Ομοίως, η ισομέρεια συνεχίζει να αυξάνεται με κάθε αύξηση του αριθμού των ατόμων άνθρακα.
Στη διαδικασία ισομερισμού, τα αλκάνια γίνονται ισομερή διακλαδισμένης αλυσίδας. Δεν χάνουν άτομα άνθρακα ή υδρογόνου. Αντίθετα, το μοριακό βάρος των ενώσεων παραμένει το ίδιο.
Γραμμικά αλκάνια:Τα αλκάνια ευθείας αλυσίδας αναφέρονται επίσης ως γραμμικά αλκάνια. Ένα πρόθεμα "n-" χρησιμοποιείται κατά την ονομασία τέτοιων αλκανίων. Στη βιομηχανία πετρελαίου, τα αλκάνια μονής αλυσίδας ή γραμμικά είναι γνωστά ως παραφίνες. Η ονομασία αυτών των αλκανίων βασίζεται στην ονοματολογία IUPAC.
CH3-CH2-CH2-CH3 (n-βουτάνιο)
CH3-CH2-CH2-CH2 -CH3 (n-πεντάνιο)
CH3-CH2-CH2-CH2 -CH2-CH3 (n-εξάνιο)
Διακλαδισμένα αλκάνια
Οι ενώσεις με περισσότερα από τρία άτομα άνθρακα σχηματίζουν είτε ευθείες αλυσίδες, διακλαδισμένες αλυσίδες ή δακτυλίους.
Με βάση τη διάταξη, υπάρχουν τρία είδη αλκανίων, τα αλκάνια ευθείας αλυσίδας, τα αλκάνια διακλαδισμένης αλυσίδας και τα κυκλοαλκάνια.
Για τα αλκάνια που σχηματίζουν ένα αλκάνιο ευθείας και διακλαδισμένης αλυσίδας, ο γενικός μοριακός τύπος είναι CnH2n+2.
Για τα αλκάνια που σχηματίζουν ένα κυκλοαλκάνιο, ο γενικός μοριακός τύπος είναι CnH2n.
 2-Μεθυλοβουτάνιο
2-Μεθυλοβουτάνιο
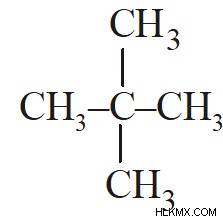 νέο πεντάνιο
νέο πεντάνιο
Φυσικές ιδιότητες των αλκανίων
Τα αλκάνια δεν έχουν χρώμα. είναι άχρωμα.
Τα αλκάνια που έχουν το χαμηλότερο μοριακό βάρος είναι αέρια, ένα με ενδιάμεσο βάρος είναι υγρά και τα υπόλοιπα είναι στερεά.
Τα αλκάνια έχουν υψηλότερα σημεία τήξης λόγω των δυνάμεων Van der Waals.
Τα αλκάνια έχουν επίσης υψηλότερο σημείο βρασμού.
Τα αλκάνια δεν πολώνονται από ηλεκτρικό πεδίο, λόγω του οποίου δεν αγώγουν ηλεκτρισμό.
Τα αλκάνια είναι υδρόφοβα, δηλαδή είναι αδιάλυτα στο νερό.
Τα αλκάνια δεν έχουν οσμή, δηλαδή είναι άοσμα.
Τα αλκάνια είναι μη πολικοί διαλύτες.
Τα αλκάνια δεν αντιδρούν και διαθέτουν μικρή βιολογική δραστηριότητα.
Τα αλκάνια έχουν χαμηλότερη πυκνότητα νερού και επιπλέουν στην επιφάνεια του νερού.
Χημικές ιδιότητες των αλκανίων
Τα αλκάνια δεν αντιδρούν.
Όταν εκτίθενται σε περίσσεια οξυγόνου, τα αλκάνια υφίστανται μια αντίδραση καύσης και σχηματίζουν αέριο διοξείδιο του άνθρακα και νερό.
Τα αλκάνια υφίστανται αλογόνωση με χλώριο και βρώμιο παρουσία υπεριωδών ακτίνων για να σχηματίσουν χλωριούχα αλκάνια και βρωμιούχα αλκάνια.
Τα αλκάνια υφίστανται μια αντίδραση καύσης με οξυγόνο, η οποία καθιστά δύσκολη την ανάφλεξή τους.
Τα αλκάνια υφίστανται μια καταλυτική μέθοδο που διασπά τα μεγαλύτερα μόρια σε μικρότερα, με αποτέλεσμα το σχηματισμό ελεύθερων ριζών.
Εμφάνιση αλκανίων
Τα αλκάνια αποτελούν ένα πολύ μικρό τμήμα της εξωτερικής ατμόσφαιρας πολλών πλανητών όπως ο Δίας, ο Κρόνος, ο Ουρανός, ο Ποσειδώνας.
Τα ίχνη αερίου μεθανίου στη γη παράγονται κυρίως από μεθανογόνους μικροοργανισμούς. Τα αλκάνια με ζυγό αριθμό ατόμων άνθρακα σπάνε εύκολα, γεγονός που διευκολύνει την αποικοδόμησή τους από ορισμένα βακτήρια.
Τα αλκάνια παράγονται στη φύση από πολλά βακτήρια, αρχαία, μύκητες και πολλά φυτά.
Σε εμπορικό επίπεδο, το φυσικό αέριο και το πετρέλαιο είναι οι πιο σημαντικές πηγές αλκανίων.
Λόγω της αδιάλυτης φύσης των αλκανίων, η παρουσία τους στους ωκεανούς ή στα υδάτινα σώματα είναι σχεδόν αμελητέα. Όμως, υπό υψηλή πίεση και χαμηλή θερμοκρασία, τα μεθάνια μπορούν να υποστούν κρυστάλλωση με νερό για να σχηματίσουν κλαθρικό μεθάνιο, το οποίο είναι μια στερεή μορφή μεθανίου.
Συμπέρασμα
Τα αλκάνια διαθέτουν διάφορες χημικές και φυσικές ιδιότητες που τα καθιστούν ευέλικτα. Λόγω των ιδιοτήτων τους, τα αλκάνια χρησιμοποιούνται ευρέως σε πολλούς καθημερινούς σκοπούς.
Το σπρέι αεροζόλ και οι καυστήρες αερίου είναι κατασκευασμένοι από προπάνιο και βουτάνιο, τα οποία υγροποιούνται σε χαμηλές θερμοκρασίες.
Τα αλκάνια με άνθρακα από πέντε έως οκτώ, δηλαδή από πεντάνιο έως οκτάνιο, χρησιμοποιούνται σε έναν κινητήρα εσωτερικής καύσης.
Μεθάνιο και αιθάνιο υπάρχουν στο φυσικό αέριο, το οποίο χρησιμοποιείται για μαγείρεμα και θέρμανση και εξοικονόμηση ενέργειας.
Τα αλκάνια αποτελούν τις σημαντικότερες πρώτες ύλες της χημικής βιομηχανίας και αποτελούν το κύριο συστατικό της βενζίνης και των λιπαντικών ελαίων.
Τα αλκάνια χρησιμοποιούνται επίσης ως λιπάσματα που προέρχονται από την παραγωγή αμμωνίας με τη διαδικασία Haber-Bosch.