Σταθερότητα διαμορφώσεων
Σε ένα μοριακό τροχιακό σίγμα, το Η κατανομή των ηλεκτρονίων εξισορροπείται γύρω από τον διαπυρηνικό άξονα του δεσμού άνθρακα-άνθρακα (C-C). Ως εκ τούτου, επιτρέπει την ελεύθερη περιστροφή γύρω από τον απλό δεσμό C-C. Οι τρισδιάστατες διατάξεις των ατόμων άνθρακα στο διάστημα παρατηρούνται λόγω αυτής της περιστροφής και αυτά τα άτομα μπορούν να μετατραπούν το ένα σε άλλο.
Μια τέτοια τρισδιάστατη διάταξη των Τα άτομα υδρογόνου και άνθρακα, τα οποία μπορούν εύκολα να μετασχηματιστούν μεταξύ τους με τη διαδικασία περιστροφής γύρω από τον δεσμό C-C, είναι γνωστά ως διαμορφώσεις, διαμορφωτές ή περιστροφικά. Ωστόσο, λόγω της απωστικής αλληλεπίδρασης, αυτές οι περιστροφές δεν είναι ελεύθερες μεταξύ των ηλεκτρονίων των νεφών των δεσμών C-H. Αυτός ο τύπος πιο απωθητικής αλληλεπίδρασης είναι γνωστός ως στρεπτική τάση.
Ισομέρεια διαμόρφωσης
Ας κατανοήσουμε τα βασικά της διαμόρφωσης με το παράδειγμα του αιθανίου.
Η διαμορφωτική ισομέρεια είναι ένας τύπος στερεοϊσομέρειας στον οποίο οι αλληλομετατροπές ισομερών πιθανώς λαμβάνουν χώρα με τη διαδικασία περιστροφής γύρω από ένα ενιαίο δεσμό. Σε αυτή τη διαδικασία, η περιστροφική ενέργεια λειτουργεί ως φράγμα μόνο σε περιπτώσεις περιστροφής τύπου απλού δεσμού. Πρέπει να ξεπεραστεί για την αλληλομετατροπή ενός τύπου διαμορφωτή σε άλλο. Για να συμβεί διαμορφωτική ισομέρεια, το φράγμα της ενέργειας θα πρέπει να είναι μικρό. Τα διαμορφωτικά ισομερή είναι διαφόρων τύπων όπως αιθάνιο και βουτάνιο.
Μπορούμε να ταξινομήσουμε αυτά τα διαμορφωτικά ισομερή ευρέως σε δύο κύριες περιπτώσεις:
Σύνθετη διαμόρφωση:Αυτή είναι ένας τύπος διαμόρφωσης όπου τα άτομα υδρογόνου είναι διατεταγμένα με τέτοιο τρόπο ώστε να συνδέονται με τους άνθρακες που είναι όσο το δυνατόν πλησιέστερα μεταξύ τους.
Κλιμακόμενη διαμόρφωση:Σε κλιμακωτές διαμορφώσεις, τα άτομα υδρογόνου συνδέονται με τους άνθρακες και τοποθετούνται όσο το δυνατόν πιο μακριά το ένα από το άλλο. Αυτός ο τύπος διαμόρφωσης είναι πιο σταθερός σε σύγκριση με τη διαμόρφωση έκλειψης επειδή αποτελείται από λιγότερες απωστικές δυνάμεις και λιγότερη ενέργεια λόγω πολλών διαχωρισμών στα μεσαία νέφη της ενέργειας, δηλαδή δεσμούς C-H.
Παράγοντες που επηρεάζουν τη σταθερότητα των Conformers
Μερικοί από τους παράγοντες που επηρεάζουν τη σταθερότητα των διαμορφωτών είναι:
Απόταση γωνίας:Αυτός ο τύπος παραμόρφωσης γενικά αντιπροσωπεύει την κυκλική δομή, αλλά δεν υπάρχει στην κυκλική δομή . Οποιαδήποτε απόκλιση από τον κανονικό τύπο γωνιών συνδυάζεται με τη γωνιακή τάση.
Σέλεχος Van der Waals:Η ομάδα των ατόμων που δεν είναι δεσμοί που βρίσκονται μακριά και πότε πλησιάζουν το ένα στο άλλο υπάρχει απώθηση, είναι γνωστό ως στέλεχος van der Waals.
Στρεπτική καταπόνηση και στερική παραμόρφωση
Στην προβολή Newman, μελετάμε την ενέργεια του αντι, του γκάς και άλλων διαμορφώσεις. Οι ομάδες gauche και eclipsing αποσταθεροποιούν τη διαμόρφωση της στερικής τάσης ή της στρεπτικής τάσης. Το στερεικό εμπόδιο είναι μια ευρεία έννοια και προκύπτει όταν οι ομάδες των ατόμων είναι πολύ κοντά μεταξύ τους και υπάρχει μια ξαφνική αύξηση της ενέργειας λόγω της απώθησης των νεφών ηλεκτρονίων.
Η στρεπτική τάση προκύπτει κυρίως από τις ομάδες έκλειψης. Η αύξηση της ποσότητας ενέργειας από τις ομάδες έκλειψης των κοντινών ανθράκων είναι γνωστή ως η στρεπτική άνοδος των ομάδων έκλειψης.
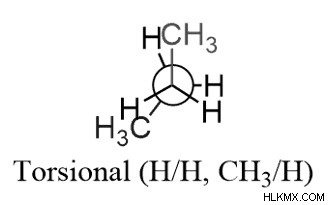
Η ύπαρξη και των δύο στελεχών , στρεπτική και στερική, προκύπτει με την έκλειψη δύο μεγάλων ομάδων:
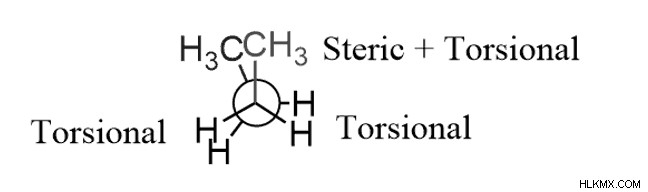
Οι αλληλεπιδράσεις των δύο ομάδων gauche βρίσκονται πάντα σε στερεό εμπόδιο. Οι διαμορφώσεις Gauche είναι πάντα λιγότερο σταθερές λόγω της υψηλής ενέργειας σε σύγκριση με την αντιδιαμόρφωση λόγω της στερικής καταπόνησης, η οποία σχετίζεται με τις μεγαλύτερες ομάδες κοντά η μία στην άλλη. (60o έναντι 180o).
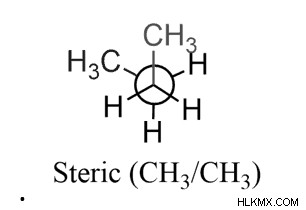
Συμπέρασμα
Σε ένα μοριακό τροχιακό σίγμα, η κατανομή των ηλεκτρονίων εξισορροπείται γύρω από τον διαπυρηνικό άξονα του δεσμού C-C . Ως εκ τούτου, επιτρέπει την ελεύθερη περιστροφή γύρω από τον απλό δεσμό C-C. Οι τρισδιάστατες διατάξεις των ατόμων άνθρακα στο διάστημα παρατηρούνται λόγω αυτής της περιστροφής και αυτά τα άτομα μπορούν να μετατραπούν το ένα σε άλλο.
Η διαμορφωτική ισομέρεια είναι ένα είδος στερεοϊσομέρειας στο οποίο οι αλληλομετατροπές ισομερών λαμβάνουν χώρα με περιστροφές εντός ενός μόνο δεσμού. Σε αυτή τη διαδικασία, η περιστροφική ενέργεια λειτουργεί ως φράγμα μόνο σε περιπτώσεις περιστροφής τύπου απλού δεσμού. Μερικοί παράγοντες που επηρεάζουν τη σταθερότητα των διαμορφωτών είναι η παραμόρφωση van der Waals, η στερική τάση, η στρεπτική τάση και η γωνιακή τάση.
Σχετικές σελίδες
| Ειδοποιήσεις JEE | Υλικό μελέτης JEE |
| Διαφορά μεταξύ JEE | Σημαντικές φόρμουλες JEE |
| Συμβουλές για τις εξετάσεις JEE | Πλήρες φόρμες JEE |
| Μέσες τετραγωνικές ταχύτητες ρίζας | Τύπος ακτινωτών και γωνιακών κόμβων |
| Μαγνητικές ιδιότητες των στοιχείων d-Block | Περιορισμοί της θεωρίας του Arrhenius |
| Η εξίσωση Nernst και οι εφαρμογές της | Θεωρίες γαλακτωματοποίησης |