Διαφορά μεταξύ υδρογόνου και οξυγόνου
Κύρια διαφορά – Υδρογόνο έναντι Οξυγόνου
Ο περιοδικός πίνακας στοιχείων δείχνει κάθε στοιχείο που έχει μέχρι τώρα ανακαλυφθεί στη γη σύμφωνα με τον ατομικό τους αριθμό (αύξουσα σειρά). Μερικά από αυτά τα στοιχεία είναι πολύ άφθονα στη γη, ενώ άλλα στοιχεία βρίσκονται σε ίχνη. Το υδρογόνο και το οξυγόνο είναι δύο στοιχεία που βρίσκονται σχεδόν παντού στη γη. Η κύρια διαφορά μεταξύ Υδρογόνου και Οξυγόνου είναι ότι Το Υδρογόνο δεν έχει νετρόνια στο πιο σταθερό ισότοπό του, ενώ το Οξυγόνο έχει 8 νετρόνια στο πιο σταθερό ισότοπό του.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Υδρογόνο
– Ορισμός, Ισότοπα, Δομή, Ιδιότητες, Αφθονία
2. Τι είναι το Οξυγόνο
– Ορισμός, Ισότοπα, Δομή, Ιδιότητες, Αφθονία
3. Ποια είναι η διαφορά μεταξύ υδρογόνου και οξυγόνου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλλότροπα, ατομικός αριθμός, ηλεκτρόνιο, υδρογόνο, ισότοπα, νετρόνιο, οξυγόνο, πρωτόνιο, πρωτείο 
Τι είναι το Υδρογόνο
Το υδρογόνο είναι ένα στοιχείο με ατομικό αριθμό 1 και σύμβολο H . Είναι το στοιχείο που βρίσκεται στην κορυφή του περιοδικού πίνακα. Το υδρογόνο έχει τρία φυσικά απαντώμενα ισότοπα. Είναι το πρωτίου, το δευτέριο και το τρίτιο. Διαφέρουν μεταξύ τους ως προς τον αριθμό των νετρονίων που έχουν στον πυρήνα τους. Μεταξύ αυτών των ισοτόπων, το πιο συνηθισμένο ισότοπο είναι το πρώτιο . Η αφθονία του πρωτίου στη φύση είναι περίπου 98%. Επομένως, ο όρος Υδρογόνο συνήθως αναφέρεται στο Protium.
Το υδρογόνο δεν έχει νετρόνια, μόνο ένα πρωτόνιο και ένα ηλεκτρόνιο. Το υδρογόνο έχει μόνο ένα s τροχιακό και όχι άλλα τροχιακά. Επομένως, το μόνο ηλεκτρόνιο που έχει το άτομο του υδρογόνου βρίσκεται στο τροχιακό s. Δεδομένου ότι αυτό το ηλεκτρόνιο είναι μόνο και ασύζευκτο, το Υδρογόνο μπορεί να σχηματίσει ιόν Η εύκολα αφαιρώντας αυτό το ηλεκτρόνιο. Η παρουσία ενός μη ζευγαρωμένου ηλεκτρονίου καθιστά το άτομο του Υδρογόνου ασταθές. Επομένως, το Υδρογόνο τείνει να σχηματίζει ομοιοπολικούς δεσμούς με πολλά διαφορετικά στοιχεία μοιράζοντας το ηλεκτρόνιό του μαζί τους.
Η πιο κοινή μορφή Υδρογόνου που βρίσκεται στη φύση είναι τα μόρια του νερού. Δύο άτομα υδρογόνου συνδέονται ομοιοπολικά με ένα άτομο οξυγόνου σε ένα μόριο νερού. Ο μοριακός τύπος του νερού δίνεται ως H2 Ο. Εκτός από αυτό, το Υδρογόνο βρίσκεται σε υδρογονάνθρακες, πολλά κοινά πολυμερή και άλλα οργανικά και ανόργανα είδη. Το υδρογόνο βρίσκεται στην ατμόσφαιρα ως αέριο υδρογόνο. Ο μοριακός τύπος του αερίου Υδρογόνου είναι H2 . Εκεί, δύο άτομα υδρογόνου συνδέονται μέσω ενός ομοιοπολικού δεσμού μοιράζοντας το μόνο ηλεκτρόνιο που έχουν.
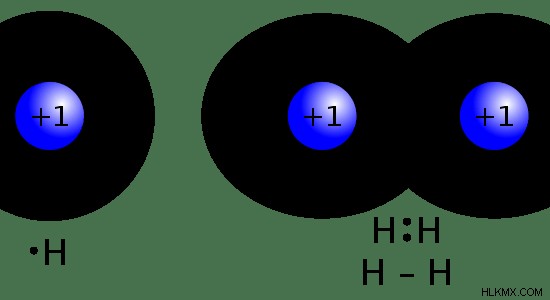
Εικόνα 01: Χημική δομή H και H2
Σε τυπική θερμοκρασία και πίεση, το Υδρογόνο είναι ένα άχρωμο, άοσμο και μη τοξικό αέριο. Είναι πολύ εύφλεκτο. Όταν H2 Το αέριο αντιδρά με μεταλλικά στοιχεία, σχηματίζει το Χάνιο. Αυτό το ανιόν ονομάζεται υδρίδιο. Ο δεσμός μεταξύ μετάλλου και υδριδίου είναι ιοντικός και το άτομο υδρογόνου έχει δύο ηλεκτρόνια (ζευγμένα) στο ανιόν υδριδίου.
Τι είναι το Oxygen
Το οξυγόνο είναι ένα στοιχείο με ατομικό αριθμό 8 και σύμβολο O . Το φυσικώς απαντώμενο οξυγόνο έχει τρία ισότοπα. Είναι το O, το O και το O. Αλλά η πιο άφθονη μορφή είναι το O. Επομένως, όταν μιλάμε γενικά για οξυγόνο, αναφερόμαστε στο ισότοπο O.
Το οξυγόνο έχει 8 πρωτόνια και 8 νετρόνια στον πυρήνα του. Έχει επίσης 8 ηλεκτρόνια γύρω από τον πυρήνα. Αυτά τα ηλεκτρόνια βρίσκονται σε τροχιακά s και p. Η διαμόρφωση ηλεκτρονίων του Οξυγόνου είναι 1s2s2p. Καθώς το πιο εξωτερικό τροχιακό που περιέχει ηλεκτρόνια είναι το p τροχιακό, το οξυγόνο ανήκει στο μπλοκ p του περιοδικού πίνακα. Το οξυγόνο έχει 4 ηλεκτρόνια στο τροχιακό 2p. Δύο από αυτά είναι ζευγαρωμένα και άλλα δύο ηλεκτρόνια είναι ασύζευκτα. Επομένως, το οξυγόνο μπορεί να κάνει ανιόν Ο λαμβάνοντας δύο ηλεκτρόνια από το εξωτερικό. Όταν αποκτώνται δύο ηλεκτρόνια, το οξυγόνο παίρνει τη διαμόρφωση ηλεκτρονίων του Νέον, η οποία είναι μια πολύ σταθερή διαμόρφωση.
Μορφές οξυγόνου O2 αέριο. Είναι το αέριο που χρειάζεται κάθε ζωντανό ον για την αναπνοή του. Το ποσοστό O2 αέριο στην ατμόσφαιρα είναι περίπου 21%. Ως εκ τούτου, το οξυγόνο βρίσκεται πιο άφθονα στην ατμόσφαιρα. Το οξυγόνο βρίσκεται επίσης ως μέρος των μορίων του νερού. Εκεί, το άτομο οξυγόνου συνδέεται με δύο άτομα υδρογόνου μέσω ομοιοπολικών δεσμών. Το οξυγόνο είναι το δεύτερο πιο ηλεκτραρνητικό στοιχείο και είναι δεύτερο μόνο μετά το φθόριο.
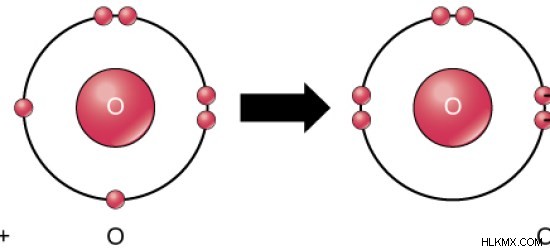
Εικόνα 02:Σχηματισμός μορίου O2
Σε τυπική θερμοκρασία και πίεση, το οξυγόνο εμφανίζεται ως διατομικό μόριο που είναι άοσμο, άχρωμο και μη τοξικό. Υπάρχουν δύο αλλότροπα οξυγόνου ως O2 και O3 . O2 ονομάζεται τυπικά διοξυγόνο ή οξυγόνο ενώ το O3 ονομάζεται όζον. Το όζον βρίσκεται κυρίως στο στρώμα του όζοντος στην ανώτερη ατμόσφαιρα.
Διαφορά μεταξύ υδρογόνου και οξυγόνου
Ορισμός
Υδρογόνο: Το υδρογόνο είναι ένα στοιχείο με ατομικό αριθμό 1 και σύμβολο H.
Οξυγόνο: Το οξυγόνο είναι ένα στοιχείο με ατομικό αριθμό 8 και σύμβολο O.
Αριθμός Νετρονίων
Υδρογόνο: Το πιο κοινό ισότοπο του Υδρογόνου δεν έχει νετρόνια στον πυρήνα του.
Οξυγόνο: Το πιο κοινό ισότοπο του Οξυγόνου έχει 8 νετρόνια στον πυρήνα του.
Τροχιακά
Υδρογόνο: Το υδρογόνο έχει μόνο ένα τροχιακό s.
Οξυγόνο: Το οξυγόνο έχει s και p τροχιακά.
Αριθμός μη συζευγμένων ηλεκτρονίων
Υδρογόνο: Το υδρογόνο έχει ένα ασύζευκτο ηλεκτρόνιο.
Οξυγόνο: Το οξυγόνο έχει δύο ασύζευκτα ηλεκτρόνια.
Αριθμός ομοιοπολικών δεσμών
Υδρογόνο: Το υδρογόνο μπορεί να σχηματίσει μόνο έναν ομοιοπολικό δεσμό.
Οξυγόνο: Το οξυγόνο μπορεί να σχηματίσει δύο ομοιοπολικούς δεσμούς.
Ατομική μάζα
Υδρογόνο: Η ατομική μάζα του Υδρογόνου είναι περίπου 1,00794 u.
Οξυγόνο: Η ατομική μάζα του οξυγόνου είναι 15.999 u.
Συμπέρασμα
Τόσο το Υδρογόνο όσο και το Οξυγόνο είναι πολύ άφθονο στον φλοιό της γης. Επομένως, είναι σημαντικό να κατανοήσουμε τη διαφορά μεταξύ υδρογόνου και οξυγόνου. Αυτά τα στοιχεία βρίσκονται είτε στην αέρια φάση ως τα διατομικά τους μόρια είτε ως στερεές ή υγρές φάσεις όταν συνδέονται με άλλα στοιχεία.




