Διαφορά μεταξύ σθένους και κατάστασης οξείδωσης
Κύρια διαφορά – Σθένος έναντι κατάστασης οξείδωσης
Όλες οι ενώσεις αποτελούνται από άτομα διαφορετικών στοιχείων. Αυτά τα άτομα συνδυάζονται σε διαφορετικές αναλογίες ανάλογα με τον αριθμό των διαθέσιμων ελεύθερων τροχιακών που έχουν ή τον αριθμό των ηλεκτρονίων που μπορεί να απελευθερώσει ένα συγκεκριμένο άτομο. Το σθένος και η κατάσταση οξείδωσης είναι δύο όροι που χρησιμοποιούνται για να εξηγήσουν τους λόγους για αυτούς τους διαφορετικούς συνδυασμούς ατόμων. Η κύρια διαφορά μεταξύ σθένους και κατάστασης οξείδωσης είναι ότι σθένος είναι ο αριθμός των ηλεκτρονίων που υπάρχουν στο εξώτατο κέλυφος ενός ατόμου ενός συγκεκριμένου στοιχείου, ενώ η κατάσταση οξείδωσης είναι ο αριθμός των ηλεκτρονίων που ένα στοιχείο σε μια συγκεκριμένη ένωση έχει χάσει ή αποκτήσει .
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Valency
– Ορισμός, Ένδειξη, Παραδείγματα
2. Τι είναι η κατάσταση οξείδωσης
– Ορισμός, ένδειξη, κανόνες για τον προσδιορισμό της κατάστασης οξείδωσης, παραδείγματα
3. Ποια είναι η διαφορά μεταξύ του σθένους και της κατάστασης οξείδωσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, Σύνθεση, Στοιχείο, Κέλυφος, Κατάσταση Οξείδωσης, Σθένος 
Τι είναι το Valency
Το σθένος μπορεί να οριστεί ως ο αριθμός των ηλεκτρονίων που υπάρχουν στο εξώτατο κέλυφος ενός συγκεκριμένου στοιχείου. Το σθένος καθορίζει τον μέγιστο αριθμό δεσμών που μπορεί να έχει ένα συγκεκριμένο άτομο. Τα στοιχεία στον περιοδικό πίνακα ομαδοποιούνται σύμφωνα με τον αριθμό των ηλεκτρονίων σθένους (ηλεκτρόνια στα εξώτατα τροχιακά) που μπορεί να έχει ένα άτομο όταν βρίσκεται σε ουδέτερη και αέρια κατάσταση. Ο παρακάτω πίνακας θα το εξηγήσει αυτό.
Στοιχείο | Ατομικός αριθμός | Διαμόρφωση ηλεκτρονίων | Σθένος |
| Νάτριο (Na) | 11 | 1s2s2p3s | 1 |
| Μαγνήσιο (Mg) | 12 | 1s2s2p3s | 2 |
| Βόριο (Β) | 5 | 1s2s 2π | 3 |
| Άνθρακας (C) | 6 | 1s2s 2π | 4 |
| Θείο (S) | 16 | 1s2s2p3s 3π | 6 |
Τα στοιχεία της ίδιας ομάδας στον περιοδικό πίνακα έχουν το ίδιο σθένος, καθώς τα στοιχεία ομαδοποιούνται σύμφωνα με τον ατομικό αριθμό και ο αριθμός των ηλεκτρονίων που υπάρχουν στο εξώτατο κέλυφος είναι ο ίδιος όταν εξετάζουμε τις διαμορφώσεις ηλεκτρονίων τους.
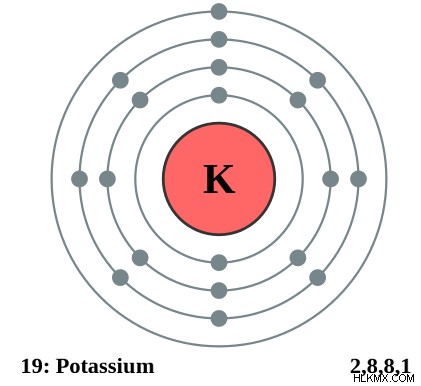
Εικόνα 1:Το σθένος του καλίου είναι 1
Τι είναι η κατάσταση οξείδωσης
Η κατάσταση οξείδωσης μπορεί να οριστεί ως ο αριθμός των ηλεκτρονίων που ένα συγκεκριμένο άτομο μπορεί να χάσει, να αποκτήσει ή να μοιραστεί με ένα άλλο άτομο. Η απώλεια ή το κέρδος ηλεκτρονίων προκαλεί την αλλαγή του φορτίου ενός ατόμου αφού τα ηλεκτρόνια είναι αρνητικά φορτισμένα και κάθε αρνητικό φορτίο εξουδετερώνεται από το θετικό φορτίο των πρωτονίων στον πυρήνα. Όταν ένα άτομο χάνει ή κερδίζει ηλεκτρόνια, θα υπάρχει ανισορροπία ηλεκτρικών φορτίων. Επομένως, η κατάσταση οξείδωσης αυτού του ατόμου είναι το φορτίο αυτού του ατόμου. Η κατάσταση οξείδωσης μπορεί να χρησιμοποιηθεί για να περιγράψει το φορτίο ενός ατόμου που βρίσκεται σε μια ένωση.
Η κατάσταση οξείδωσης δίνεται χρησιμοποιώντας το θετικό (+) ή το αρνητικό (-) σύμβολο μαζί με έναν αριθμό. Το σύμβολο περιγράφει το φορτίο αυτού του ατόμου και ο αριθμός περιγράφει τον αριθμό των ηλεκτρονίων που έχουν ανταλλαγεί.
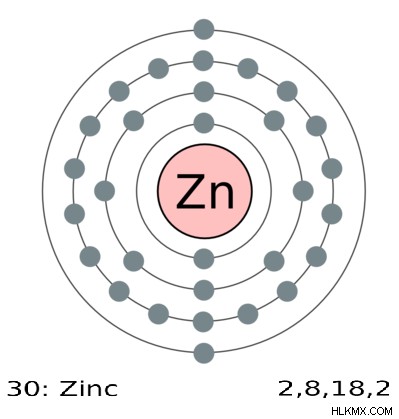
Εικόνα 2:0 και +2 είναι οι μόνες καταστάσεις οξείδωσης του ψευδαργύρου
Πώς να προσδιορίσετε την κατάσταση οξείδωσης
Η κατάσταση οξείδωσης ενός ατόμου υπολογίζεται σύμφωνα με επτά κανόνες. Αυτοί οι κανόνες και μερικά παραδείγματα για καταστάσεις οξείδωσης δίνονται παρακάτω.
Κανόνας 1
Η κατάσταση οξείδωσης ενός στοιχείου είναι πάντα μηδέν. Τα στοιχεία στη στοιχειακή τους μορφή βρίσκονται επίσης σε κατάσταση μηδενικής οξείδωσης.
Παράδειγμα:Η κατάσταση οξείδωσης του νατρίου (Na) είναι 0 και αυτή του Υδρογόνου (H2 ) είναι 0
Κανόνας 2
Το συνολικό φορτίο του μορίου ή του ιόντος πρέπει να είναι το άθροισμα των φορτίων κάθε ατόμου στην ένωση.
Π.χ.: Η συνολική χρέωση KCl είναι 0
Το φορτίο (κατάσταση οξείδωσης) του K είναι +1
Το φορτίο (κατάσταση οξείδωσης) του Cl είναι -1
Κανόνας 3
Η κατάσταση οξείδωσης των στοιχείων της ομάδας 1 είναι πάντα +1.
Κανόνας 4
Η κατάσταση οξείδωσης των στοιχείων της ομάδας 2 είναι πάντα +2.
Κανόνας 5
Το αρνητικό φορτίο δίνεται στο πιο ηλεκτραρνητικό άτομο σε σύγκριση με τα άλλα άτομα που είναι συνδεδεμένα με αυτό.
Π.χ.:Το φθόριο είναι το πιο ηλεκτραρνητικό στοιχείο. Επομένως, κάθε φορά που βρίσκεται σε δεσμό με άλλο στοιχείο, το φθόριο λαμβάνει -1 κατάσταση οξείδωσης.
Κανόνας 6
Η κατάσταση οξείδωσης του υδρογόνου (Η) είναι +1.
Αλλά όταν είναι με μέταλλα της ομάδας 1, η κατάσταση οξείδωσης του υδρογόνου είναι -1.
Κανόνας 7
Η κατάσταση οξείδωσης του οξυγόνου (Ο) είναι -2.
Αλλά στα υπεροξείδια, η κατάσταση οξείδωσης του Ο είναι -1.
| Σύνθετο | Στοιχείο X | Κατάσταση οξείδωσης του X |
| NH3 | X =N | -3 |
| KMnO4 | X =Mn | +7 |
| Cr2 O7 | X =Cr | +6 |
Διαφορά μεταξύ σθένους και κατάστασης οξείδωσης
Ορισμός
Σθένος: Το σθένος μπορεί να οριστεί ως ο αριθμός των ηλεκτρονίων που υπάρχουν στο εξώτατο κέλυφος ενός συγκεκριμένου στοιχείου.
Οξείδωση: Η κατάσταση οξείδωσης μπορεί να οριστεί ως ο αριθμός των ηλεκτρονίων που ένα συγκεκριμένο άτομο μπορεί να χάσει, να αποκτήσει ή να μοιραστεί με ένα άλλο άτομο.
Ηλεκτρική φόρτιση
Σθένος: Το σθένος δεν υποδηλώνει το ηλεκτρικό φορτίο ενός ατόμου σε μια ένωση.
Οξείδωση: Η κατάσταση οξείδωσης υποδεικνύει το ηλεκτρικό φορτίο ενός ατόμου σε μια ένωση.
Σύνδεση
Σθένος: Το σθένος καθορίζει τον μέγιστο αριθμό δεσμών που μπορεί να έχει ένα άτομο.
Οξείδωση: Η κατάσταση οξείδωσης δεν υποδεικνύει τον αριθμό των δεσμών που μπορεί να έχει ένα συγκεκριμένο άτομο.
Καθαρά στοιχεία
Σθένος: Το σθένος ενός καθαρού στοιχείου εξαρτάται από τον αριθμό των ηλεκτρονίων που έχει στο εξωτερικό του κέλυφος ενός ατόμου (άτομο σε αέρια φάση).
Οξείδωση: Η κατάσταση οξείδωσης ενός καθαρού στοιχείου είναι πάντα μηδέν.
Συμπέρασμα
Το σθένος και η κατάσταση οξείδωσης μπορεί να έχουν τις ίδιες τιμές ή διαφορετικές τιμές. Το σθένος είναι ο αριθμός των ηλεκτρονίων που υπάρχουν στο εξώτατο κέλυφος ενός συγκεκριμένου στοιχείου, ενώ η κατάσταση οξείδωσης είναι ο αριθμός των ηλεκτρονίων που ένα στοιχείο σε μια συγκεκριμένη ένωση έχει χάσει ή αποκτήσει. Αυτή είναι η κύρια διαφορά μεταξύ σθένους και κατάστασης οξείδωσης.




