Διαφορά μεταξύ του ρυθμού αντίδρασης και της σταθεράς ταχύτητας
Κύρια διαφορά – Ρυθμός αντίδρασης έναντι σταθεράς ταχύτητας
Μια χημική αντίδραση περιλαμβάνει ουσιαστικά προϊόντα και αντιδρώντα. Εκτός από αυτό, απαιτούνται ορισμένες σημαντικές προϋποθέσεις για να προχωρήσει μια χημική αντίδραση μέχρι την ολοκλήρωσή της. Τέτοιες από αυτές τις συνθήκες περιλαμβάνουν την κατάλληλη θερμοκρασία και πίεση, ιοντική ισχύ, κ.λπ. Ωστόσο, κάθε χημική αντίδραση μπορεί να εξηγηθεί χρησιμοποιώντας τους δύο όρους:ρυθμός αντίδρασης και σταθερά ταχύτητας. Ο ρυθμός αντίδρασης περιγράφει τον ρυθμό με τον οποίο προχωρά η αντίδραση και η σταθερά ταχύτητας ποσοτικοποιεί την ταχύτητα μιας αντίδρασης. Η κύρια διαφορά μεταξύ του ρυθμού αντίδρασης και της σταθεράς ταχύτητας είναι ότι ταχύτητα αντίδρασης είναι η αλλαγή της συγκέντρωσης των αντιδρώντων ή η αλλαγή στη συγκέντρωση των προϊόντων ανά μονάδα χρόνου ενώ η σταθερά ταχύτητας είναι η σταθερά αναλογικότητας που σχετίζεται με τον ρυθμό μιας συγκεκριμένης αντίδρασης.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο ρυθμός αντίδρασης
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι το Rate Constant
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ του ρυθμού αντίδρασης και της σταθεράς ταχύτητας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ιονική ισχύς, Προϊόντα, Σταθερά Ρυθμού, Ρυθμός Αντίδρασης, Αντιδρώντα

Τι είναι το Rate of Reaction
Ο ρυθμός αντίδρασης ή ο ρυθμός αντίδρασης είναι η αλλαγή στη συγκέντρωση των αντιδρώντων ή η αλλαγή στη συγκέντρωση των προϊόντων ανά μονάδα χρόνου. Αυτό μπορεί να επιτευχθεί με δύο τρόπους. Το ένα είναι διαιρώντας τη συγκέντρωση των αντιδρώντων που καταναλώθηκαν κατά τη διάρκεια της αντίδρασης από το χρόνο που πέρασε για αυτήν την κατανάλωση. Η άλλη μέθοδος είναι η διαίρεση της συγκέντρωσης των προϊόντων που σχηματίζονται στο τέλος της αντίδρασης από το χρόνο που πέρασε για αυτόν τον σχηματισμό. Αυτό μπορεί να συντομευτεί όπως παρακάτω.
Ρυθμός =[Συγκέντρωση] / Χρόνος
Αλλά τις περισσότερες φορές, όλα τα αντιδρώντα δεν καταναλώνονται για την αντίδραση. Επομένως, η συγκέντρωση των συστατικών λαμβάνεται ως «μεταβολή της συγκέντρωσης» σε μια συγκεκριμένη χρονική περίοδο. Αυτό δίνεται από το σύμβολο Δ. Εάν οι συγκεντρώσεις μετρηθούν όταν ο χρόνος είναι t1 και μετά στο t2 , τότε ο χρόνος που απαιτείται για την αντίδραση είναι (t2 -t1 ) =χρόνος που πέρασε (Δt). Επομένως, ο χρόνος λαμβάνεται ως Δt. Στη συνέχεια, ο ρυθμός αντίδρασης μπορεί να μετρηθεί ακόμη και πριν από την ολοκλήρωση της αντίδρασης.
Ρυθμός = Δ[αντιδρών] / Δ χρόνος =Δ[προϊόν] / χρόνος Δ
Ας εξετάσουμε μια αντίδραση μεταξύ Α και Β που δίνει το προϊόν C.
A + B → Γ
Για την παραπάνω αντίδραση, ο ρυθμός της αντίδρασης μπορεί να μετρηθεί προσδιορίζοντας τη μεταβολή της συγκέντρωσης των A, B ή C.
Τιμή =– Δ [A] / Δt
Τιμή =– Δ [B] / Δt
Ποσοστό =Δ[C] / Δt
Σημειώστε ότι υπάρχει ένα σημάδι μείον μπροστά από τις συγκεντρώσεις των Α και Β. Αυτό χρησιμοποιείται για να υποδείξει τη μείωση των αντιδρώντων κατά τη χρονική περίοδο του Δt. Αλλά δεν υπάρχει κανένα σημάδι μείον μπροστά από τη συγκέντρωση του C. Αυτό συμβαίνει επειδή το C δεν καταναλώνεται αλλά παράγεται, οπότε η συγκέντρωση του C αυξάνεται καθ' όλη τη διάρκεια της αντίδρασης.
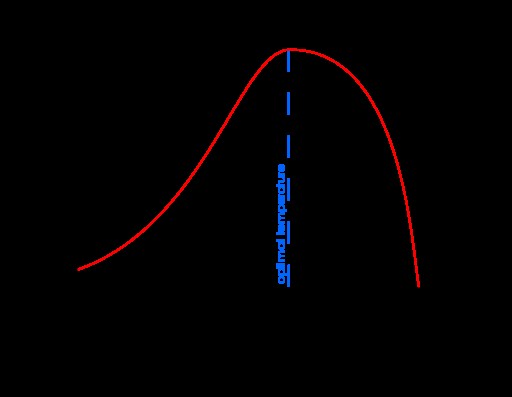
Εικόνα 1:Το γράφημα του ρυθμού αντίδρασης έναντι της θερμοκρασίας
Το παραπάνω γράφημα δείχνει την εξάρτηση του ρυθμού αντίδρασης από τη θερμοκρασία μιας ενζυμικής αντίδρασης. Η βέλτιστη θερμοκρασία είναι η θερμοκρασία στην οποία ο ρυθμός αντίδρασης βρίσκεται στο μέγιστο.
Τι είναι η Rate Constant
Η σταθερά ταχύτητας είναι η σταθερά αναλογικότητας που σχετίζεται με τον ρυθμό μιας συγκεκριμένης αντίδρασης. Εξαρτάται από τη θερμοκρασία του συστήματος. Οι σταθερές ταχύτητας δίνουν μια ιδέα για την ταχύτητα μιας αντίδρασης. Το σύμβολο για τη σταθερά ρυθμού είναι "k". Για παράδειγμα, για την αντίδραση μεταξύ Α και Β που δίνει το γινόμενο C,
Βαθμολογία = – Δ [A] / Δt
∴ Βαθμολογία α [A]
Βαθμολογία = – Δ [B] / Δt
∴ Βαθμολογία α [B]
Οι παραπάνω σχέσεις μπορούν να χρησιμοποιηθούν για την κατασκευή μιας εξίσωσης για τον ρυθμό της αντίδρασης όπως παρακάτω.
Τιμή =k[A][B]
όπου,
k είναι η σταθερά ρυθμού.
Το [A] είναι η συγκέντρωση του A Το [B] είναι η συγκέντρωση του Ba είναι η σειρά της αντίδρασης ως προς το A
b είναι η σειρά της αντίδρασης ως προς το B
Για μια συγκεκριμένη θερμοκρασία, οι σταθερές ρυθμού έχουν μια καθορισμένη τιμή που θα αλλάζει ανάλογα με τις αλλαγές στη θερμοκρασία. Αυτή η εξάρτηση από τη θερμοκρασία δίνεται από την εξίσωση που ονομάζεται "Equation Arrhenius".
K =Ae
όπου,
K είναι η σταθερά ρυθμού
Το A είναι ο προεκθετικός παράγοντας
EA είναι η ενέργεια ενεργοποίησης για την αντίδραση
R είναι η καθολική σταθερά αερίου
T είναι η θερμοκρασία του συστήματος
Αυτή η εξίσωση υποδεικνύει την επίδραση της αλλαγής θερμοκρασίας στη σταθερά του ρυθμού καθώς και την επίδραση ενός καταλύτη. Η αύξηση της θερμοκρασίας αυξάνει τη σταθερά του ρυθμού. Η προσθήκη ενός καταλύτη στο μείγμα αντίδρασης μειώνει την ενέργεια ενεργοποίησης και αυξάνει τη σταθερά του ρυθμού.
Διαφορά μεταξύ του ρυθμού αντίδρασης και της σταθεράς ταχύτητας
Ορισμός
Ρυθμός αντίδρασης: Ο ρυθμός αντίδρασης είναι η αλλαγή στη συγκέντρωση των αντιδρώντων ή η αλλαγή στη συγκέντρωση των προϊόντων ανά μονάδα χρόνου.
Βαθμολογήστε σταθερά: Η σταθερά ταχύτητας είναι η σταθερά αναλογικότητας που σχετίζεται με τον ρυθμό μιας συγκεκριμένης αντίδρασης.
Μοριακή συγκέντρωση
Ρυθμός αντίδρασης: Ο ρυθμός αντίδρασης εξαρτάται από τις μοριακές συγκεντρώσεις των αντιδρώντων και των προϊόντων.
Σταθερά ποσοστού: Η σταθερά ταχύτητας δεν εξαρτάται από τις μοριακές συγκεντρώσεις των αντιδρώντων και των προϊόντων.
Θερμοκρασία
Ρυθμός αντίδρασης: Ο ρυθμός αντίδρασης εξαρτάται έμμεσα από τη θερμοκρασία.
Σταθερά ποσοστού: Η σταθερά ρυθμού εξαρτάται ουσιαστικά από τη θερμοκρασία.
Ώρα
Ρυθμός αντίδρασης: Ο ρυθμός αντίδρασης εξαρτάται από το χρόνο που απαιτείται για την αντίδραση.
Σταθερά ποσοστού: Η σταθερά ταχύτητας δεν εξαρτάται από το χρόνο που απαιτείται για την αντίδραση.
Συμπέρασμα
Ο ρυθμός αντίδρασης και η σταθερά ταχύτητας είναι πολύ σημαντικές για τον προσδιορισμό των καλύτερων συνθηκών (όπως η θερμοκρασία) για μια συγκεκριμένη χημική αντίδραση. Τότε θα ήταν εύκολο να χειριστείτε τις αντιδράσεις και θα μπορούσατε να πάρετε τις βέλτιστες ποσότητες προϊόντος σε σύντομο χρονικό διάστημα. Επομένως, είναι πολύ σημαντικό να κατανοήσουμε τις ιδιότητες και τις διαφορές μεταξύ του ρυθμού αντίδρασης και της σταθεράς ταχύτητας.