Διαφορά μεταξύ Valence και Valency
Κύρια διαφορά – Valence vs Valency
Το σθένος και το σθένος περιγράφονται σε σχέση με τα ηλεκτρόνια που υπάρχουν σε ένα άτομο. Τα ηλεκτρόνια είναι γνωστό ότι βρίσκονται σε κελύφη ή τροχιακά γύρω από τον πυρήνα. Επομένως, τα ηλεκτρόνια μπορούν να χαθούν από ένα άτομο ανάλογα με την ισχύ της δύναμης έλξης μεταξύ αυτών των ηλεκτρονίων και του πυρήνα ενός ατόμου. Το σθένος και το σθένος σχετίζονται με τα ηλεκτρόνια στο εξώτατο τροχιακό ενός ατόμου. Η κύρια διαφορά μεταξύ σθένους και σθένους είναι ότι το σθένος αναφέρεται στην ικανότητα ενός ατόμου να συνδυάζεται με ένα άλλο άτομο ενώ το σθένος αναφέρεται στον μέγιστο αριθμό ηλεκτρονίων που μπορεί να χάσει ή να κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Valence
– Ορισμός, εξήγηση με παραδείγματα
2. Τι είναι το Valency
– Ορισμός, εξήγηση με παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ Valence και Valency
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ Valence και Valency
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, Άτομο Άνθρακα, Ηλεκτρόνια, Άτομο Υδρογόνου, Άζωτο, Κανόνας Οκτάδας, Τροχιακό Διάγραμμα, Σθένος, Ηλεκτρόνια σθένους, Σθένος 
Τι είναι το Valence
Το σθένος αναφέρεται στην ικανότητα ενός ατόμου να συνδυάζεται με ένα άλλο άτομο. Με άλλα λόγια, είναι ο βαθμός ισχύος συνδυασμού ενός συγκεκριμένου ατόμου. Το σθένος ενός ατόμου σχετίζεται με τον αριθμό των ηλεκτρονίων που υπάρχουν στο εξώτατο τροχιακό ενός ατόμου. Αυτά τα ηλεκτρόνια ονομάζονται ηλεκτρόνια σθένους. Για να συνδυαστεί με ένα άλλο άτομο, ένα συγκεκριμένο άτομο θα πρέπει να έχει ηλεκτρόνια σθένους που μπορούν είτε να χαθούν είτε να αποκτηθούν είτε να ζευγαρωθούν. Αυτό οφείλεται στο γεγονός ότι ένας συνδυασμός δύο ατόμων μπορεί να είναι τόσο μέσω ενός ιοντικού δεσμού ή ενός ομοιοπολικού δεσμού και και στους δύο αυτούς τύπους, τα άτομα χάνουν ηλεκτρόνια, αποκτούν ηλεκτρόνια ή μοιράζονται ηλεκτρόνια.
Το σθένος ενός ατόμου μπορεί να δοθεί ως ο αριθμός των μονοσθενών ατόμων που μπορούν να συνδεθούν σε αυτό το άτομο ή ο αριθμός των απλών δεσμών που μπορεί να έχει ένα άτομο. Αυτό μπορεί επίσης να οριστεί ως ο αριθμός των ατόμων υδρογόνου (Η) που μπορούν να συνδεθούν σε ένα άτομο. Αυτό συμβαίνει επειδή τα άτομα υδρογόνου είναι μονοσθενή και μπορούν εύκολα να συνδεθούν με άλλα άτομα. Μερικά άτομα μπορούν να συνδεθούν με άλλα άτομα σε διαφορετικές αναλογίες. Επομένως, ένα άτομο μπορεί να έχει πολλαπλά σθένη.
Σθένος = Βαθμός συνδυαστικής ισχύος
= Αριθμός μονοσθενών ατόμων που μπορούν να προσαρτηθούν
= Αριθμός ατόμων H που μπορούν να προσαρτηθούν.
Για παράδειγμα, το άτομο υδρογόνου μπορεί να συνδεθεί μόνο σε ένα άτομο υδρογόνου ή σε οποιοδήποτε άλλο μονοσθενές άτομο. Επομένως, το σθένος του Υδρογόνου είναι 1.

Εικόνα 01:Ατομική Δομή Υδρογόνου
Διαμόρφωση ηλεκτρονίων του Υδρογόνου: 1s
Τροχιακό διάγραμμα υδρογόνου :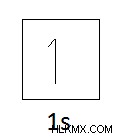
Ως εκ τούτου, το Υδρογόνο έχει μόνο ένα χώρο για τα εισερχόμενα ηλεκτρόνια. Εάν όχι, το Υδρογόνο μπορεί να χάσει μόνο ένα ηλεκτρόνιο. Άρα μπορεί να συνδυαστεί με ένα μόνο μονοσθενές άτομο. Επομένως, το σθένος του Υδρογόνου είναι 1.
Ας εξετάσουμε το άζωτο. Ο ατομικός αριθμός του Αζώτου είναι 7.
Διαμόρφωση ηλεκτρονίων του αζώτου: 1s2s2p
Τροχιακό διάγραμμα αζώτου: 
Σύμφωνα με το τροχιακό διάγραμμα του Αζώτου, έχει τρία κενά για τα εισερχόμενα ηλεκτρόνια. Αυτό οφείλεται στο ότι έχει τρία ασύζευκτα ηλεκτρόνια και μπορούν να ζευγαρωθούν μοιράζοντας ηλεκτρόνια από άλλο άτομο. Με άλλα λόγια, το άζωτο μπορεί να συνδεθεί με ένα, δύο ή τρία άτομα υδρογόνου. Διαφορετικά, το άζωτο μπορεί να χάσει ένα, δύο ή τρία ηλεκτρόνια. Επομένως, ένα άτομο μπορεί να έχει πολλαπλά σθένη.
Επιπλέον, το σθένος ενός ατόμου αντιπροσωπεύεται από ένα θετικό (+) ή αρνητικό (-) σημάδι. Αυτό γίνεται για να δείξει την απώλεια ή το κέρδος αυτών των ηλεκτρονίων. Για τα παραπάνω παραδείγματα, το σθένος του Υδρογόνου μπορεί να είναι είτε +1 είτε -1. Τα Σθένη του Αζώτου είναι -3, -2, -1, +2, +3.
Τι είναι το Valency
Το σθένος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χάσει ή να κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί. Αυτός ο όρος σχετίζεται κυρίως με τα ηλεκτρόνια σθένους, καθώς ο αριθμός των ηλεκτρονίων σθένους καθορίζει το σθένος ενός συγκεκριμένου ατόμου.
Για παράδειγμα, ας εξετάσουμε το άτομο άνθρακα.
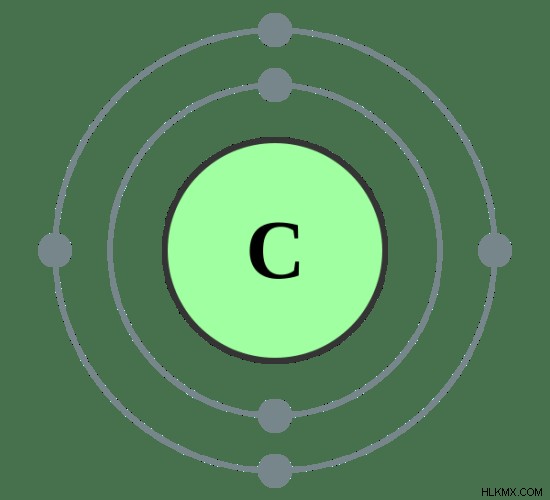
Εικόνα 02:Ατομική δομή άνθρακα
Διαμόρφωση ηλεκτρονίων του άνθρακα 1s2s2p
Τροχιακό διάγραμμα άνθρακα :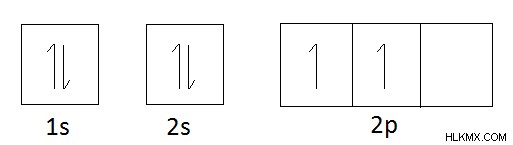
Σύμφωνα με το τροχιακό διάγραμμα του άνθρακα, θα πρέπει να αποκτήσει 4 ηλεκτρόνια για να υπακούσει στον κανόνα της οκτάδας. (Κανόνας Οκτάδας δείχνει ότι συνολικά οκτώ ηλεκτρόνια στο εξώτατο τροχιακό των ατόμων είναι η πιο σταθερή μορφή αυτών των ατόμων). Αφού ληφθούν 4 ηλεκτρόνια, ο συνολικός αριθμός ηλεκτρονίων στο n=2 τροχιακό (2s και 2p) γίνεται 8. Επομένως, το σθένος του άνθρακα είναι 4.
Ομοιότητες μεταξύ Valence και Valency
Το σθένος ενός ατόμου είναι ίσο με ένα από τα σθένη αυτού του ατόμου. Αυτό συμβαίνει επειδή ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χαθούν, να αποκτηθούν ή να μοιραστούν ένα άτομο καθορίζει την ισχύ συνδυασμού αυτού του ατόμου. Επομένως, αν και οι ορισμοί είναι διαφορετικοί, η τιμή τόσο του σθένους όσο και του σθένους μπορεί να είναι η ίδια.
Διαφορά μεταξύ Σθένους και Σθένους
Ορισμός
Σθένος: Το σθένος είναι η ικανότητα ενός ατόμου να συνδυάζεται με ένα άλλο άτομο.
Σθένος: Το σθένος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χάσει ή να κερδίσει ένα άτομο προκειμένου να σταθεροποιηθεί.
Αναπαράσταση
Σθένος: Το σθένος δίνεται ως ακέραιος αριθμός, που αντιπροσωπεύεται με σύμβολο + ή – πριν από τον αριθμό.
Σθένος: Το σθένος δίνεται μόνο ως αριθμός χωρίς πρόσημο + ή –.
Τιμές
Σθένος: Το σθένος ενός ατόμου μπορεί να έχει πολλαπλές τιμές.
Σθένος: Το σθένος ενός ατόμου έχει μόνο μία τιμή.
Συμπέρασμα
Υπάρχει μια μικρή διαφορά μεταξύ σθένους και σθένους με βάση τους ορισμούς και την αναπαράστασή τους, παρόλο που το σθένος και το σθένος ενός ατόμου αναφέρονται στην ίδια έννοια. Το σθένος δίνει τον αριθμό των δεσμών που μπορεί να έχει ένα άτομο, ενώ το σθένος δίνει τον μέγιστο αριθμό δεσμών που μπορεί να έχει ένα άτομο.
Εικόνα Ευγενική προσφορά:
1. "Electron shell 001 Hydrogen – no label" By commons:User:Pumbaa (πρωτότυπο έργο από την commons:User:Greg Robson) (αντίστοιχη έκδοση με ετικέτα), (CC BY-SA 2.0 uk) μέσω Commons Wikimedia
2 . "Electron shell 006 Carbon – no label" By Pumbaa (πρωτότυπο έργο του Greg Robson) – Αρχείο:Electron shell 006 Carbon.svg (CC BY-SA 2.0 uk) μέσω Commons Wikimedia