Διαφορά μεταξύ αλλοτρόπων και ισοτόπων
Κύρια διαφορά – Αλλοτρόπια εναντίον Ισότοπων
Τα χημικά στοιχεία μπορούν να εμφανιστούν φυσικά σε πολλές διαφορετικές μορφές. Μερικές φορές, τα στοιχεία βρίσκονται σε συνδυασμό με άλλα στοιχεία, και μερικές φορές, στοιχεία βρίσκονται στη στοιχειακή τους μορφή όπως ο χρυσός (Au). Ωστόσο, ορισμένα στοιχεία εμφανίζονται φυσικά σε διαφορετικές μορφές αλλά βρίσκονται στην ίδια φυσική κατάσταση. Τέτοια στοιχεία ονομάζονται αλλότροπα. Υπάρχουν επίσης στοιχεία που έχουν διαφορετικές μορφές ατομικών δομών. Ονομάζονται Ισότοπα. Η κύρια διαφορά μεταξύ αλλότροπων και ισοτόπων είναι ότι τα αλλότροπα ορίζονται στο μοριακό τους επίπεδο ενώ τα ισότοπα ορίζονται στο ατομικό τους επίπεδο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα αλλότροπα
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι τα Ισότοπα
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ αλλοτρόπων και ισοτόπων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλλοτροπία, αλλοτροπία, άνθρακας, χρυσός, υδρογόνο, ισότοπα, θείο 
Τι είναι τα αλλότροπα
Τα αλλότροπα είναι διαφορετικές μορφές του ίδιου χημικού στοιχείου που είναι σταθερές στην ίδια φυσική κατάσταση. Στα αλλότροπα, τα άτομα του ίδιου στοιχείου συνδέονται μεταξύ τους με διαφορετικούς τρόπους. Με άλλα λόγια, η χωρική διάταξη των ατόμων είναι διαφορετική από το ένα αλλότροπο στο άλλο. Ένα αλλότροπο αποτελείται μόνο από άτομα του ίδιου στοιχείου. Δεν υπάρχουν συνδυασμοί ατόμων διαφορετικών στοιχείων.
Η φυσική κατάσταση των αλλοτροπών του ίδιου χημικού στοιχείου είναι η ίδια. Αλλά οι μοριακοί τύποι των αλλοτροπών μπορεί να είναι είτε ίσοι είτε διαφορετικοί μεταξύ τους. Επομένως, οι χημικές και φυσικές ιδιότητες των αλλοτρόπων μπορεί να είναι διαφορετικές μεταξύ τους.
Αλλοτροπία είναι ο όρος που χρησιμοποιείται για να περιγράψει την παρουσία ή την απουσία αλλοτροπών για ένα συγκεκριμένο χημικό στοιχείο. Όλα τα χημικά στοιχεία δεν έχουν αλλότροπα. Μόνο μερικά στοιχεία δείχνουν αλλοτροπία. Μερικά κοινά παραδείγματα συζητούνται παρακάτω.
Άνθρακας (C)
Ο άνθρακας είναι ένα σημαντικό χημικό στοιχείο που εμφανίζει αλλοτροπία. Τα πιο κοινά αλλοτρόπα του άνθρακα είναι ο γραφίτης και το διαμάντι. Τόσο ο γραφίτης όσο και το διαμάντι αποτελούνται μόνο από άτομα άνθρακα. Αλλά η μοριακή δομή, ο υβριδισμός των ατόμων άνθρακα και άλλες φυσικές ιδιότητες τους είναι διαφορετικές μεταξύ τους.
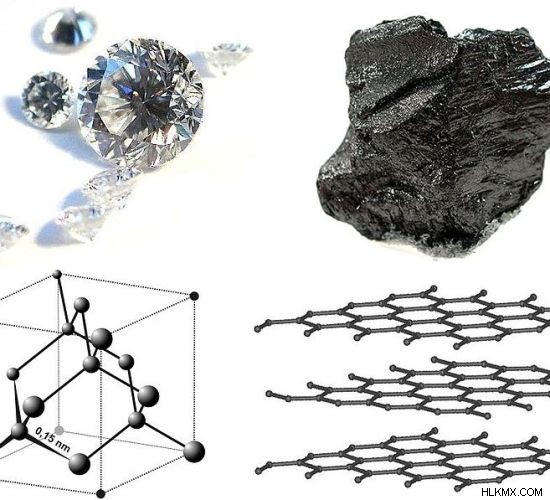
Εικόνα 01:Χημικές δομές και οι εμφανίσεις του διαμαντιού και του γραφίτη
Οξυγόνο
Τα αλλότροπα του οξυγόνου είναι Διοξυγόνο (O2 ) και το Όζον (O3 ). Και οι δύο βρίσκονται στην αέρια φάση στη φύση και διαφέρουν μεταξύ τους λόγω της μοριακής δομής, των χημικών και φυσικών ιδιοτήτων.
Θείο
Το θείο στη φύση βρίσκεται ως S8 μονάδες. Αυτές οι μονάδες αποτελούνται από οκτώ άτομα θείου. Εδώ, ένα άτομο θείου συνδέεται με δύο άλλα άτομα θείου σχηματίζοντας μια κυκλική δομή. Αυτές οι κυκλικές δομές μπορεί να είναι είτε σε ρομβική δομή, σε μορφή βελόνας (Μονοκλινική) ή σε ορθορομβική μορφή. Η γενική δομή του S8 είναι η δομή της κορώνας.
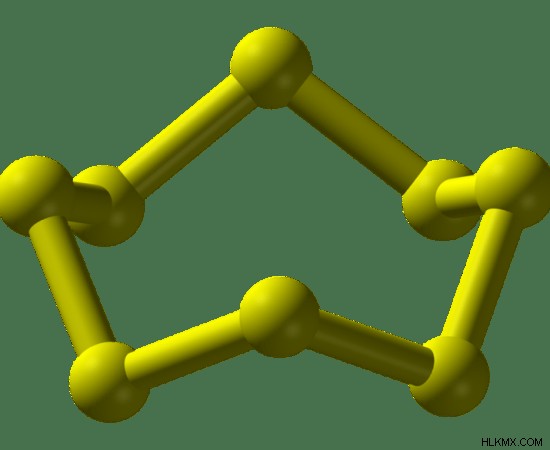
Εικόνα 02:Δομή κορώνας του S8
Η αλλοτροπία ορίζεται για μόρια σε φυσική κατάσταση. Επομένως, το υγρό νερό και ο πάγος δεν είναι αλλότροπα, παρόλο που και τα δύο αποτελούνται μόνο από μόρια νερού (H2 O).
Τι είναι τα ισότοπα
Τα ισότοπα είναι διαφορετικές μορφές ατομικών δομών του ίδιου χημικού στοιχείου. Γενικά, ένα άτομο αποτελείται από έναν πυρήνα και ένα νέφος ηλεκτρονίων που περιβάλλει αυτόν τον πυρήνα. Ο πυρήνας αποτελείται από πρωτόνια και νετρόνια, ενώ το νέφος ηλεκτρονίων αποτελείται μόνο από ηλεκτρόνια. Ένα στοιχείο αποτελείται από ένα μοναδικό αριθμό πρωτονίων. Ο ατομικός αριθμός ενός στοιχείου είναι ο αριθμός των πρωτονίων. Επομένως, κάθε χημικό στοιχείο έχει έναν μοναδικό ατομικό αριθμό. Ο περιοδικός πίνακας στοιχείων είναι κατασκευασμένος με βάση τους ατομικούς αριθμούς των στοιχείων. Εδώ, τα χημικά στοιχεία είναι διατεταγμένα με αύξουσα σειρά του ατομικού αριθμού. Ωστόσο, ο αριθμός των νετρονίων που υπάρχουν στον πυρήνα δεν είναι μοναδική τιμή για τα στοιχεία. Τα άτομα του ίδιου στοιχείου μπορεί να έχουν διαφορετικό αριθμό νετρονίων στον πυρήνα τους. Αυτά τα άτομα ονομάζονται ισότοπα.
Τα ισότοπα ενός συγκεκριμένου στοιχείου μπορεί να είναι είτε σταθερά είτε ασταθή. Τα ασταθή ισότοπα ενδέχεται να υποστούν ραδιενεργό διάσπαση για να αποκτήσουν σταθερή μορφή. Μερικά από τα πιο κοινά Ισότοπα δίνονται παρακάτω.
Υδρογόνο (Η)
Ο ατομικός αριθμός του Υδρογόνου είναι 1. Επομένως, αποτελείται από 1 πρωτόνιο. Υπάρχουν 3 κοινά Ισότοπα Υδρογόνου. Είναι το Protium, το Deuterium και το Tritium. Το Protium δεν έχει νετρόνια. Το δευτέριο έχει ένα νετρόνιο και το τρίτιο έχει δύο νετρόνια στον πυρήνα τους.
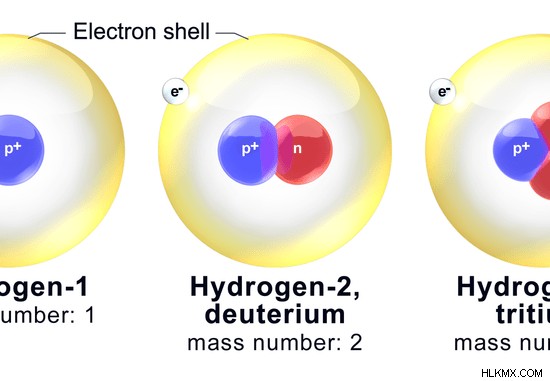
Εικόνα 03:Ισότοπα υδρογόνου
Ήλιο
Το ήλιο αποτελείται από δύο πρωτόνια. Τα φυσικά ισότοπα ηλίου έχουν 1 νετρόνιο ή 2 νετρόνια.
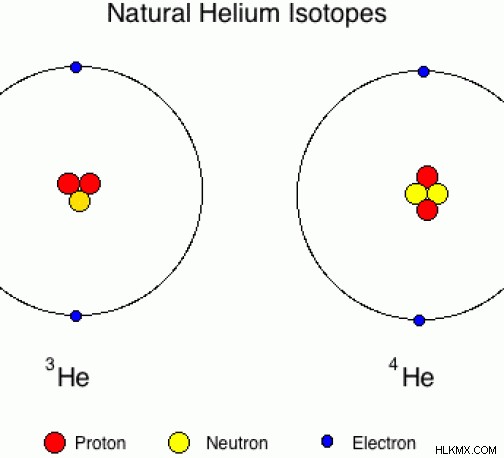
Εικόνα 04:Ισότοπα ηλίου
Άνθρακας
Τα άτομα άνθρακα εμφανίζονται επίσης σε μορφές ισοτόπων. Το πιο κοινό ισότοπο του άνθρακα αποτελείται από 6 νετρόνια. Ορισμένα ισότοπα άνθρακα έχουν 7 ή 8 νετρόνια.
Διαφορά μεταξύ αλλοτρόπων και ισοτόπων
Ορισμός
Αλλότροπα: Τα αλλότροπα είναι διαφορετικές μορφές του ίδιου χημικού στοιχείου, οι οποίες είναι σταθερές στην ίδια φυσική κατάσταση.
Ισότοπα: Τα ισότοπα είναι διαφορετικές μορφές ατομικών δομών του ίδιου χημικού στοιχείου.
Φύση
Αλλότροπα: Τα αλλότροπα περιγράφουν μοριακές δομές.
Ισότοπα: Τα ισότοπα περιγράφουν τις ατομικές δομές.
Μάζα
Αλλότροπα: Η μοριακή μάζα των αλλοτροπών μπορεί να είναι είτε ίση είτε διαφορετική μεταξύ τους.
Ισότοπα: Ο ατομικός αριθμός των ισοτόπων είναι ο ίδιος, αλλά οι ατομικές μάζες είναι διαφορετικές μεταξύ τους.
Αφθονία
Αλλότροπα: Τα αλλότροπα δεν βρίσκονται σε όλα τα χημικά στοιχεία.
Ισότοπα: Ισότοπα βρίσκονται σχεδόν σε όλα τα στοιχεία.
Χημικές ιδιότητες
Αλλότροπα: Οι χημικές ιδιότητες των αλλοτροπών είναι διαφορετικές μεταξύ τους.
Ισότοπα: Οι χημικές ιδιότητες των ισοτόπων είναι παρόμοιες λόγω της παρουσίας ίσου αριθμού ηλεκτρονίων.
Σταθερότητα
Αλλότροπα: Τα αλλότροπα είναι σταθερά μόρια που βρίσκονται φυσικά.
Ισότοπα: Ορισμένα ισότοπα είναι σταθερά ενώ άλλα είναι ασταθή.
Συμπέρασμα
Τόσο τα αλλότροπα όσο και τα ισότοπα αναφέρονται σε διαφορετικές μορφές ενός συγκεκριμένου χημικού στοιχείου. Τα αλλότροπα εξηγούν τις διαφορές στις μοριακές δομές. Τα ισότοπα εξηγούν τις διαφορές στις ατομικές δομές. Αυτή είναι η κύρια διαφορά μεταξύ αλλοτροπών και ισοτόπων. Τα αλλότροπα μπορεί είτε να έχουν πολύ μικρές διαφορές στις ιδιότητές τους είτε μεγάλες διαφορές. Αλλά τα περισσότερα ισότοπα είναι διαφορετικά μεταξύ τους ανάλογα με τη σταθερότητά τους και όχι με άλλες ιδιότητες. Οι χημικές ιδιότητες των ισοτόπων θα ήταν ίδιες επειδή έχουν τον ίδιο αριθμό ηλεκτρονίων. Σχεδόν όλες οι χημικές ιδιότητες εξαρτώνται από τον αριθμό και τη διάταξη των ηλεκτρονίων.




