Διαφορά μεταξύ ομοιοπολικών και δεσμών υδρογόνου
Κύρια διαφορά – Ομοιοπολικοί δεσμοί έναντι υδρογόνου
Οι χημικοί δεσμοί είναι δεσμοί που εμφανίζονται μεταξύ ατόμων. Αυτοί οι χημικοί δεσμοί είναι χρήσιμοι για τη συγκράτηση των ατόμων μαζί προκειμένου να σχηματιστούν μόρια και σύνθετες ενώσεις. Οι χημικοί δεσμοί σχηματίζονται είτε λόγω της ανταλλαγής ηλεκτρονίων μεταξύ των ατόμων είτε λόγω της έλξης μεταξύ ατόμων, ιόντων ή μορίων. Ο ομοιοπολικός δεσμός και ο δεσμός υδρογόνου είναι δύο τύποι χημικών δεσμών που μπορούν να βρεθούν μεταξύ ομοιοπολικών ενώσεων. Ένας ομοιοπολικός δεσμός σχηματίζεται λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ των ατόμων. Ένας δεσμός υδρογόνου σχηματίζεται λόγω της έλξης μεταξύ δύο ατόμων δύο διαφορετικών μορίων. Η κύρια διαφορά μεταξύ ομοιοπολικών και δεσμών υδρογόνου είναι ότι οι ομοιοπολικοί δεσμοί είναι ενδομοριακές έλξεις ενώ οι δεσμοί υδρογόνου είναι διαμοριακές έλξεις.
Βασικές περιοχές που καλύπτονται
1. Τι είναι οι ομοιοπολικοί δεσμοί
– Ορισμός, σχηματισμός δεσμού με παραδείγματα
2. Τι είναι οι δεσμοί υδρογόνους
– Ορισμός, σχηματισμός δεσμού με παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ ομοιοπολικών και δεσμών υδρογόνος
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ ομοιοπολικών και δεσμών υδρογόνου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:άτομα, δύναμη έλξης, ομοιοπολικός δεσμός, δεσμός υδρογόνου, διαμοριακές έλξεις, ενδομοριακές έλξεις, ιόντα, μόρια
Τι είναι οι ομοιοπολικοί δεσμοί
Οι ομοιοπολικοί δεσμοί είναι χημικοί δεσμοί που σχηματίζονται λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ των ατόμων. Επομένως, ονομάζεται διαμοριακή δύναμη έλξης. Ο δεσμός σχηματίζεται μεταξύ δύο ατόμων που περιέχουν ασύζευκτα ηλεκτρόνια. Αυτά τα ασύζευκτα ηλεκτρόνια ζευγαρώνονται με τα μη ζευγαρωμένα ηλεκτρόνια ενός άλλου ατόμου για να σχηματίσουν έναν ομοιοπολικό δεσμό.
Τα άτομα μπορεί να έχουν ομοιοπολικούς δεσμούς ως απλούς δεσμούς, διπλούς δεσμούς ή τριπλούς δεσμούς μεταξύ ατόμων. Ένας ομοιοπολικός δεσμός περιλαμβάνει ένα ζεύγος ηλεκτρονίων δεσμού. Όταν ένα ασύζευκτο ηλεκτρόνιο συζευχθεί με ένα άλλο ασύζευκτο ηλεκτρόνιο διαφορετικού ατόμου, σχηματίζεται ένας ομοιοπολικός δεσμός και αυτά τα δύο ηλεκτρόνια ονομάζονται ζεύγος ηλεκτρονίων δεσμού ή ζεύγος δεσμών. Επομένως, σε έναν διπλό δεσμό, 4 ηλεκτρόνια μοιράζονται μεταξύ δύο ατόμων επειδή υπάρχουν 2 ομοιοπολικοί δεσμοί που έχουν δύο ζεύγη δεσμών.
Ο κύριος σκοπός του σχηματισμού ενός ομοιοπολικού δεσμού είναι να γεμίσει τα εξωτερικά τροχιακά των ατόμων προκειμένου να σταθεροποιηθούν. Ο ομοιοπολικός δεσμός βρίσκεται μεταξύ των μη μετάλλων και των μεταλλοειδών. Οι ομοιοπολικοί δεσμοί είναι πολύ ισχυρές έλξεις και η ισχύς του ομοιοπολικού δεσμού κυμαίνεται από 100 έως 1100 kJ/mol.
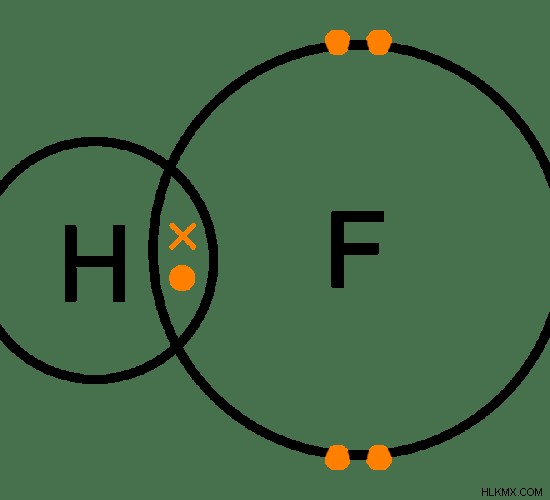
Εικόνα 1:Διασταυρούμενη δομή του υδροφθορίου
Η παραπάνω εικόνα δείχνει τον ομοιοπολικό δεσμό μεταξύ του ατόμου υδρογόνου (H) και του ατόμου φθορίου (F). Εδώ, το εγκάρσιο σημάδι υποδεικνύει το μη ζευγαρωμένο ηλεκτρόνιο στο άτομο υδρογόνου και τα σημάδια κουκκίδων δείχνουν τα ηλεκτρόνια στο εξώτατο τροχιακό του φθορίου.
Υπάρχουν δύο κύριοι τύποι ομοιοπολικών δεσμών:πολικοί ομοιοπολικοί δεσμοί και μη πολικοί ομοιοπολικοί δεσμοί. Αυτοί οι δύο δεσμοί ονομάζονται σύμφωνα με την πολικότητα του ομοιοπολικού δεσμού. Η πολικότητα του δεσμού εξαρτάται από τις τιμές ηλεκτραρνητικότητας των δύο ατόμων που συμβάλλουν στον ομοιοπολικό δεσμό. Εάν η διαφορά μεταξύ αυτών των τιμών ηλεκτραρνητικότητας είναι μικρότερη από 0,4, πρόκειται για μη πολικό ομοιοπολικό δεσμό. Εάν αυτή η τιμή είναι μεταξύ 0,4 και 1,7, είναι ένας πολικός ομοιοπολικός δεσμός. Στο παραπάνω παράδειγμα, η ηλεκτραρνητικότητα του υδρογόνου είναι 2,2 και η ηλεκτραρνητικότητα του φθορίου είναι 4,0. Επομένως η διαφορά είναι (4,0-2,2) =1,8. Επομένως, είναι ένας εξαιρετικά πολικός ομοιοπολικός δεσμός.
Τι είναι οι δεσμοί υδρογόνου
Οι δεσμοί υδρογόνου είναι δυνάμεις έλξης που εμφανίζονται μεταξύ δύο ατόμων δύο διαφορετικών μορίων. Επομένως, είναι μια ενδομοριακή έλξη. Είναι μια αδύναμη δύναμη έλξης. Αλλά σε σύγκριση με άλλους τύπους ενδομοριακών δυνάμεων, όπως πολικές-πολικές αλληλεπιδράσεις, μη πολικές-μηπολικές αλληλεπιδράσεις όπως οι δυνάμεις Vander Waal, ο δεσμός υδρογόνου είναι ισχυρότερος.
Ο δεσμός υδρογόνου εμφανίζεται μεταξύ πολικών ομοιοπολικών ενώσεων. Αυτές οι ενώσεις (ή μόρια) αποτελούνται από πολικούς ομοιοπολικούς δεσμούς. Ένας πολικός ομοιοπολικός δεσμός προκύπτει λόγω της διαφοράς στις τιμές ηλεκτραρνητικότητας των ατόμων που βρίσκονται στον ομοιοπολικό δεσμό. Εάν αυτή η διαφορά είναι υψηλή, το άκρως ηλεκτραρνητικό άτομο τείνει να έλκει τα ηλεκτρόνια του δεσμού προς το μέρος του. Αυτό δημιουργεί μια διπολική ροπή όπου αυτό το εξαιρετικά ηλεκτραρνητικό άτομο παίρνει ένα μερικό αρνητικό φορτίο ενώ το άλλο άτομο παίρνει ένα μερικό θετικό φορτίο. Τότε ο δεσμός γίνεται πολικός ομοιοπολικός δεσμός. Όταν αυτό το μόριο συναντά ένα άλλο μόριο που έχει μια διπολική ροπή όπως αυτή, τα αρνητικά και τα θετικά φορτία τείνουν να ελκύουν το ένα το άλλο. Αυτή η δύναμη έλξης ονομάζεται δεσμός υδρογόνου.
Ο δεσμός υδρογόνου συμβαίνει μεταξύ άκρως ηλεκτραρνητικά ατόμων και λιγότερο ηλεκτραρνητικά ατόμων. Δεσμοί υδρογόνου υπάρχουν όταν έχουμε O, N και F σε ένα μόριο και θετικά φορτισμένο H στο άλλο μόριο. Αυτό συμβαίνει επειδή τα F, N και O είναι τα πιο ηλεκτραρνητικά άτομα που είναι ικανά να σχηματίσουν δεσμούς υδρογόνου. Η ισχύς ενός δεσμού υδρογόνου μπορεί να κυμαίνεται από 5 έως 50 kJ/mol. Ο ισχυρότερος δεσμός υδρογόνου εμφανίζεται μεταξύ ατόμων HF.
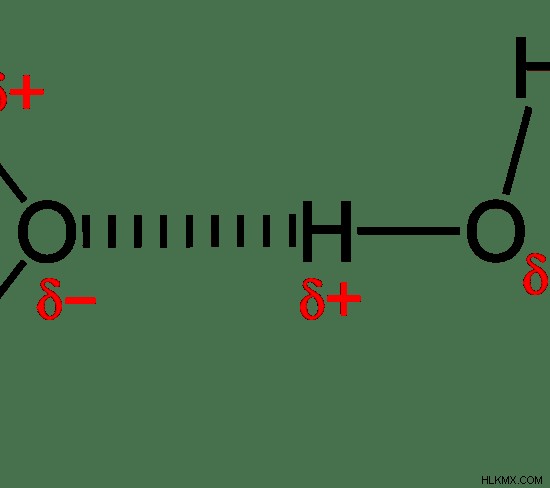
Εικόνα 2:Δεσμοί υδρογόνου μεταξύ μορίων νερού
Το νερό είναι το πιο κοινό παράδειγμα για μια ένωση που έχει δεσμούς υδρογόνου. Εδώ, το άτομο οξυγόνου ενός μορίου νερού μπορεί να προσελκύσει ένα άτομο υδρογόνου ενός άλλου μορίου λόγω του διαχωρισμού φορτίου σε αυτό το μόριο.
Ομοιότητες μεταξύ ομοιοπολικών και δεσμών υδρογόνου
- Οι ομοιοπολικοί δεσμοί και οι δεσμοί υδρογόνου είναι τύποι χημικών δεσμών.
- Και οι δύο τύποι δεσμών εμφανίζονται μεταξύ δύο ατόμων.
- Και οι δύο τύποι δεσμών λειτουργούν ως κόλλα μεταξύ δύο ατόμων.
Διαφορά μεταξύ ομοιοπολικών και δεσμών υδρογόνου
Ορισμός
Ομοιοπολικοί δεσμοί: Οι ομοιοπολικοί δεσμοί είναι χημικοί δεσμοί που σχηματίζονται λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ των ατόμων.
Δεσμοί υδρογόνου: Οι δεσμοί υδρογόνου είναι δυνάμεις έλξης που εμφανίζονται μεταξύ δύο ατόμων δύο διαφορετικών μορίων.
Nature of Bond
Ομοιοπολικοί δεσμοί: Οι ομοιοπολικοί δεσμοί είναι διαμοριακοί χημικοί δεσμοί.
Δεσμοί υδρογόνου: Οι δεσμοί υδρογόνου είναι ενδομοριακοί χημικοί δεσμοί.
Χημικά είδη
Ομοιοπολικοί δεσμοί: Ομοιοπολικοί δεσμοί σχηματίζονται μεταξύ δύο ατόμων.
Δεσμοί υδρογόνου: Οι δεσμοί υδρογόνου σχηματίζονται μεταξύ δύο ατόμων δύο διαφορετικών μορίων.
Ισχύς δεσμού
Ομοιοπολικοί δεσμοί: Η ισχύς του δεσμού του ομοιοπολικού δεσμού μπορεί να κυμαίνεται από 100 έως 1100 kJ/mol.
Δεσμοί υδρογόνου: Η ισχύς του δεσμού του δεσμού υδρογόνου μπορεί να κυμαίνεται από 5 έως 50 kJ/mol.
Συμπέρασμα
Τόσο οι ομοιοπολικοί δεσμοί όσο και οι δεσμοί υδρογόνου είναι χημικοί δεσμοί. Οι ομοιοπολικοί δεσμοί είναι ισχυρότεροι από τους δεσμούς υδρογόνου. Αυτό συμβαίνει επειδή σχηματίζεται ένας ομοιοπολικός δεσμός λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων, ενώ ένας δεσμός υδρογόνου σχηματίζεται λόγω της έλξης μεταξύ δύο μορίων. Η κύρια διαφορά μεταξύ ομοιοπολικών και δεσμών υδρογόνου είναι ότι οι ομοιοπολικοί δεσμοί είναι ενδομοριακές έλξεις ενώ οι δεσμοί υδρογόνου είναι διαμοριακές έλξεις.




