Διαφορά μεταξύ πρώτης και δεύτερης ενέργειας ιονισμού
Κύρια διαφορά – Πρώτη έναντι δεύτερης ενέργειας ιοντισμού
Η ενέργεια ιονισμού είναι η ποσότητα ενέργειας που χρειάζεται ένα αέριο άτομο για να αφαιρέσει ένα ηλεκτρόνιο από το εξώτατο τροχιακό του. Αυτή είναι η ενέργεια ιονισμού επειδή το άτομο παίρνει θετικό φορτίο μετά την απομάκρυνση ενός ηλεκτρονίου και γίνεται θετικά φορτισμένο ιόν. Κάθε χημικό στοιχείο έχει μια συγκεκριμένη ενεργειακή τιμή ιονισμού. Αυτό συμβαίνει επειδή τα άτομα ενός στοιχείου είναι διαφορετικά από τα άτομα ενός άλλου στοιχείου. Η πρώτη και η δεύτερη ενέργεια ιονισμού περιγράφουν την ποσότητα ενέργειας που απαιτείται από ένα άτομο για να αφαιρέσει ένα ηλεκτρόνιο και ένα άλλο ηλεκτρόνιο, αντίστοιχα. Η κύρια διαφορά μεταξύ της πρώτης και της δεύτερης ενέργειας ιονισμού είναι ότι το η ενέργεια πρώτου ιοντισμού έχει μικρότερη τιμή από τη δεύτερη ενέργεια ιοντισμού για ένα συγκεκριμένο στοιχείο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η ενέργεια πρώτου ιονισμού
– Ορισμός, Τάσεις στον Περιοδικό Πίνακα
2. Τι είναι η ενέργεια δεύτερης ιονισμού
– Ορισμός, Τάσεις στον Περιοδικό Πίνακα
3. Ποια είναι η διαφορά μεταξύ της πρώτης και της δεύτερης ενέργειας ιονισμού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ενέργεια Πρώτης Ιονισμού, Ιονισμός, Ενέργεια Δεύτερης Ιοντισμού, Κελύφη 
Τι είναι η ενέργεια πρώτου ιονισμού
Η ενέργεια πρώτου ιονισμού είναι η ποσότητα ενέργειας που απαιτείται από ένα αέριο, ουδέτερο άτομο για να αφαιρέσει το εξώτατο ηλεκτρόνιό του. Αυτό το εξώτατο ηλεκτρόνιο βρίσκεται στο εξώτατο τροχιακό ενός ατόμου. Επομένως, αυτό το ηλεκτρόνιο έχει την υψηλότερη ενέργεια μεταξύ άλλων ηλεκτρονίων αυτού του ατόμου. Ως εκ τούτου, η πρώτη ενέργεια ιονισμού είναι η ενέργεια που απαιτείται για την εκκένωση του ηλεκτρονίου υψηλότερης ενέργειας από ένα άτομο. Αυτή η αντίδραση είναι ουσιαστικά μια ενδόθερμη αντίδραση. Αυτό μπορεί να δοθεί σε μια αντίδραση ως εξής.
X(g) → X(g) + e
Αυτή η έννοια σχετίζεται με ένα ουδέτερα φορτισμένο άτομο, καθώς τα ουδέτερα φορτισμένα άτομα αποτελούνται μόνο από τον αρχικό αριθμό ηλεκτρονίων από τα οποία θα πρέπει να αποτελείται το στοιχείο. Ωστόσο, η ενέργεια που απαιτείται για το σκοπό αυτό εξαρτάται από τον τύπο του στοιχείου. Εάν όλα τα ηλεκτρόνια είναι ζευγαρωμένα σε ένα άτομο, απαιτεί υψηλότερη ενέργεια. Εάν υπάρχει ένα ασύζευκτο ηλεκτρόνιο, απαιτεί μικρότερη ενέργεια. Ωστόσο, η αξία εξαρτάται και από κάποια άλλα στοιχεία. Για παράδειγμα, εάν η ατομική ακτίνα είναι υψηλή, απαιτείται χαμηλή ποσότητα ενέργειας επειδή το εξώτατο ηλεκτρόνιο βρίσκεται μακριά από τον πυρήνα. Τότε η δύναμη έλξης μεταξύ αυτού του ηλεκτρονίου και του πυρήνα είναι χαμηλή. Επομένως, μπορεί εύκολα να αφαιρεθεί. Αλλά αν η ατομική ακτίνα είναι χαμηλή, τότε το ηλεκτρόνιο έλκεται σε μεγάλο βαθμό από τον πυρήνα. Τότε είναι δύσκολο να αφαιρεθεί από το άτομο.
Ο περιοδικός πίνακας στοιχείων δείχνει ένα συγκεκριμένο μοτίβο ή μια τάση μεταβολής της πρώτης ενέργειας ιονισμού σε όλες τις περιόδους του. Όταν κατεβαίνουμε μια ομάδα του περιοδικού πίνακα, η πρώτη ενέργεια ιονισμού μειώνεται αφού η ατομική ακτίνα αυξάνεται προς τα κάτω στην ομάδα.
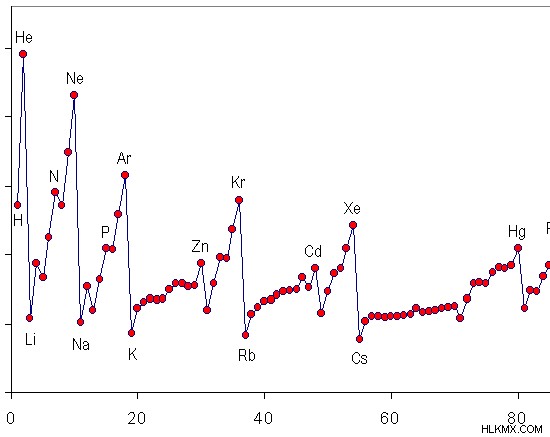
Εικόνα 1:Τάση Ενέργειας Πρώτου Ιοντισμού στον Περιοδικό Πίνακα Στοιχείων
Η παραπάνω εικόνα δείχνει πώς μεταβάλλεται η πρώτη ενέργεια ιονισμού σε μια περίοδο. Τα ευγενή αέρια έχουν τις υψηλότερες ενέργειες πρώτου ιονισμού, επειδή αυτά τα στοιχεία έχουν άτομα που αποτελούνται από πλήρως γεμάτα κελύφη ηλεκτρονίων. Επομένως, αυτά τα άτομα είναι πολύ σταθερά. Λόγω αυτής της σταθερότητας, είναι πολύ δύσκολο να αφαιρεθεί το εξώτατο ηλεκτρόνιο.
Τι είναι η Δεύτερη Ενέργεια Ιονισμού
Η δεύτερη ενέργεια ιονισμού μπορεί να οριστεί ως η ποσότητα ενέργειας που απαιτείται για την αφαίρεση ενός εξώτατου ηλεκτρονίου από ένα αέριο, θετικά φορτισμένο άτομο. Η απομάκρυνση ενός ηλεκτρονίου από ένα ουδέτερα φορτισμένο άτομο έχει ως αποτέλεσμα θετικό φορτίο. Αυτό συμβαίνει επειδή δεν υπάρχουν αρκετά ηλεκτρόνια για να εξουδετερώσουν το θετικό φορτίο του πυρήνα. Η αφαίρεση ενός άλλου ηλεκτρονίου από αυτό το θετικά φορτισμένο άτομο θα απαιτήσει πολύ υψηλή ενέργεια. Αυτή η ποσότητα ενέργειας ονομάζεται δεύτερη ενέργεια ιονισμού. Αυτό μπορεί να δοθεί σε μια αντίδραση όπως παρακάτω.
X(g) → X(g) + e
Η δεύτερη ενέργεια ιοντισμού είναι πάντα υψηλότερη από την πρώτη ενέργεια ιοντισμού, καθώς είναι πολύ δύσκολο να αφαιρεθεί ένα ηλεκτρόνιο από ένα θετικά φορτισμένο άτομο παρά από ένα ουδέτερα φορτισμένο άτομο. Αυτό συμβαίνει επειδή τα υπόλοιπα ηλεκτρόνια έλκονται σε μεγάλο βαθμό από τον πυρήνα μετά την αφαίρεση ενός ηλεκτρονίου από ένα ουδέτερο άτομο.
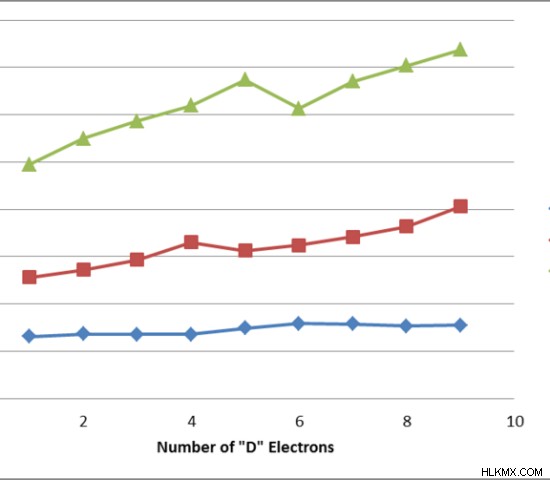
Εικόνα 2:Διαφορές μεταξύ πρώτης, δεύτερης και τρίτης ενέργειας ιονισμού σε μέταλλα μεταπτώσεως
Η παραπάνω εικόνα δείχνει τις διαφορές μεταξύ της πρώτης, της δεύτερης και της τρίτης ενέργειας ιονισμού. Αυτή η διαφορά προκύπτει επειδή η αφαίρεση ηλεκτρονίων γίνεται δύσκολη με την αύξηση του θετικού φορτίου. Επιπλέον, όταν αφαιρούνται τα ηλεκτρόνια, η ατομική ακτίνα μειώνεται. Καθιστά επίσης δύσκολη την αφαίρεση άλλου ηλεκτρονίου.
Διαφορά μεταξύ πρώτης και δεύτερης ενέργειας ιονισμού
Ορισμός
Πρώτη ενέργεια ιονισμού: Η ενέργεια πρώτου ιονισμού είναι η ποσότητα ενέργειας που απαιτείται από ένα αέριο ουδέτερο άτομο για να αφαιρέσει το εξώτατο ηλεκτρόνιό του.
Δεύτερη ενέργεια ιονισμού: Δεύτερη ενέργεια ιονισμού είναι η ποσότητα ενέργειας που απαιτείται από ένα αέριο θετικά φορτισμένο άτομο για να αφαιρέσει ένα εξώτατο ηλεκτρόνιο.
Τιμή
Πρώτη ενέργεια ιονισμού: Η πρώτη ενέργεια ιονισμού είναι συγκριτικά χαμηλή τιμή.
Δεύτερη ενέργεια ιοντισμού: Η δεύτερη ενέργεια ιονισμού είναι συγκριτικά υψηλή τιμή.
Είδη έναρξης
Πρώτη ενέργεια ιονισμού: Η πρώτη ενέργεια ιονισμού ορίζεται σε σχέση με ένα ουδέτερα φορτισμένο άτομο.
Δεύτερη ενέργεια ιοντισμού: Η δεύτερη ενέργεια ιονισμού ορίζεται για ένα θετικά φορτισμένο άτομο.
Τελικό προϊόν
Πρώτη ενέργεια ιονισμού: Το τελικό προϊόν είναι ένα φορτισμένο άτομο +1 μετά τον πρώτο ιονισμό.
Δεύτερη ενέργεια ιοντισμού: Το τελικό προϊόν είναι ένα φορτισμένο άτομο +2 μετά τον δεύτερο ιονισμό.
Συμπέρασμα
Οι τιμές ενέργειας ιονισμού είναι σημαντικές για τον προσδιορισμό της αντιδραστικότητας των χημικών στοιχείων. Είναι επίσης χρήσιμο για τον προσδιορισμό του εάν μια χημική αντίδραση θα συμβεί ή όχι. Η ενέργεια ιονισμού μερικές φορές δρα ως ενέργεια ενεργοποίησης για μια συγκεκριμένη αντίδραση. Η κύρια διαφορά μεταξύ της πρώτης και της δεύτερης ενέργειας ιοντισμού είναι ότι η ενέργεια πρώτου ιοντισμού είναι χαμηλότερη από την ενέργεια δεύτερης ιονισμού για ένα συγκεκριμένο στοιχείο.




