Διαφορά μεταξύ ωσμωτικότητας και ωσμωτικότητας
Κύρια διαφορά – Οσμωτικότητα έναντι ωσμωτικότητας
Η ωσμωτική πίεση είναι ένας όρος που αφορά τα υγρά. Είναι η πίεση που χρειάζεται για να αποφευχθεί η όσμωση. Με άλλα λόγια, η οσμωτική πίεση είναι η πίεση που πρέπει να εφαρμοστεί για να αποφευχθεί η είσοδος ενός καθαρού διαλύματος σε ένα διάλυμα που έχει διαλυμένες ουσίες μέσω όσμωσης. Η ωσμωτικότητα και η ωσμωτικότητα συνδέονται με την οσμωτική πίεση. Χρησιμοποιούνται για τη μέτρηση της ωσμωτικής πίεσης σε οσμόλη. Οσμόλη είναι ο αριθμός των mol σε μια ένωση που συμβάλλει στην οσμωτική πίεση. Η κύρια διαφορά μεταξύ της ωσμωτικότητας και της ωσμωτικότητας είναι ότι η ωσμωτικότητα είναι ένα μέτρο που λαμβάνει υπόψη τον όγκο ενός διαλύματος ενώ η ωσμωτικότητα μετράται λαμβάνοντας υπόψη τη μάζα ενός διαλύματος.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η ωσμωτικότητα
– Ορισμός, Εξήγηση με Παραδείγματα
2. Τι είναι η ωσμωτικότητα
– Ορισμός, Εξήγηση με Παραδείγματα
3. Ποια είναι η σχέση μεταξύ της ωσμωτικότητας και της ωσμωτικότητας
– Εξήγηση της εξίσωσης
4. Ποια είναι η διαφορά μεταξύ της ωσμωτικότητας και της ωσμωτικότητας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ωσμωτικότητα, ωσμωτικότητα, ωσμωτικότητα, ωσμωτική πίεση 
Τι είναι η Osmolarity
Οσμωτικότητα είναι ο αριθμός των ωσμοριακών γραμμών ανά λίτρο ενός διαλύματος που εξετάζεται. Με άλλα λόγια, είναι ένας όρος που χρησιμοποιείται για να εκφράσει τη συγκέντρωση ενός διαλύματος που παρουσιάζει οσμωτική δραστηριότητα. Αυτό σημαίνει ότι η ωσμωτικότητα είναι η συγκέντρωση ενός οσμωτικού διαλύματος. Αυτό ονομάζεται επίσης ωσμωτική συγκέντρωση.
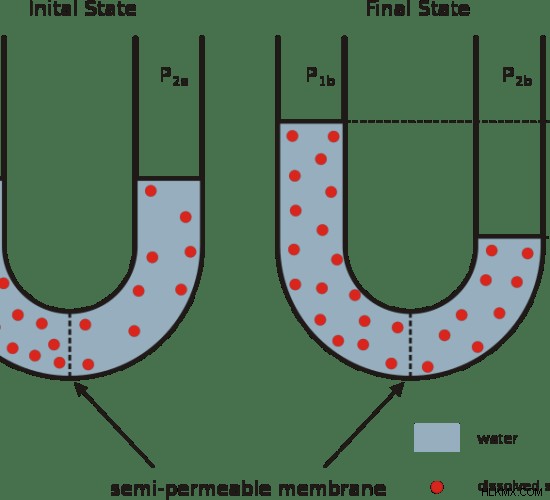
Εικόνα 1:Όσμωση
Σε αντίθεση με τη μοριακότητα, η ωσμωτικότητα μετρά τον αριθμό των σωματιδίων ανά λίτρο. Για παράδειγμα, αν λάβουμε υπόψη ένα διάλυμα NaCl, η ωσμωτικότητα δίνεται διπλάσια από τη μοριακότητα αυτού του διαλύματος. Αυτό συμβαίνει επειδή η μοριακότητα είναι ο αριθμός των γραμμομορίων Na ή Cl ανά λίτρο, ενώ η ωσμωτικότητα είναι (Na+Cl) γραμμομόρια ανά λίτρο, καθώς λαμβάνονται υπόψη όλα τα σωματίδια.
Αν εξετάσουμε ένα διάλυμα μιας ιοντικής ένωσης, όλα τα ιόντα θεωρούνται ως σωματίδια και όχι ως συγκεκριμένα ιόντα. Ένα σωματίδιο μπορεί να είναι είτε ιόν είτε μόριο. Αλλά αν θεωρήσουμε ένα διάλυμα μιας ένωσης που έχει μοριακή δομή, τότε η ένωση θα διαλύσει σχηματίζοντας μόρια. Τότε κάθε μόριο θεωρείται ως σωματίδιο.
Για παράδειγμα,
- Εάν 0,08 mol γλυκόζης διαλυθούν σε 1 λίτρο νερού,
Μοριακότητα διαλύματος γλυκόζης = 0,08 mol/L
Οσμωτικότητα διαλύματος γλυκόζης = 0,08 osmol/L
- Εάν 0,08 mol NaCl διαλυθούν σε 1 λίτρο νερού,
Μοριακότητα διαλύματος NaCl = 0,08 mol/L
Οσμωτικότητα διαλύματος NaCl = 0,16 osmol/L
Η ωσμωτικότητα δεν εξαρτάται από τον τύπο της ένωσης που διαλύεται στο διάλυμα. Απλώς μετρά την ποσότητα των σωματιδίων που υπάρχουν εκεί. Αλλά επηρεάζεται από τις αλλαγές στον διαλύτη (νερό). Αυτό συμβαίνει γιατί εάν ο όγκος του διαλύματος αυξηθεί ή μειωθεί, ο όγκος που λαμβάνεται υπόψη για τον υπολογισμό της ωσμωτικότητας μεταβάλλεται ανάλογα. Επιπλέον, η ωσμωτικότητα εξαρτάται επίσης από τη θερμοκρασία και την πίεση, καθώς ο όγκος και η διαλυτότητα των ενώσεων μπορούν να αλλάξουν αλλάζοντας αυτές τις παραμέτρους.
Τι είναι οσμωτικότητα
Οσμωτικότητα είναι ένας όρος που χρησιμοποιείται για να περιγράψει την ωσμωτική πίεση ενός διαλύματος ως προς τη μάζα του διαλύματος. Μπορεί να οριστεί ως ο αριθμός των ωσμολίων ανά ένα κιλό διαλύματος. Τα ωσμόλια είναι ο αριθμός των γραμμομορίων σωματιδίων που υπάρχουν σε αυτό το διάλυμα. Τα σωματίδια μπορεί να είναι είτε ιόντα είτε μόρια.
Δεδομένου ότι η μάζα είναι ανεξάρτητη από την πίεση και τη θερμοκρασία, αυτές οι δύο παράμετροι δεν μπορούν να επηρεάσουν την ωσμωτικότητα ενός διαλύματος. Αλλά μια αλλαγή στην περιεκτικότητα σε νερό μπορεί να επηρεάσει σε μεγάλο βαθμό την ωσμωτικότητα αφού αλλάζει τη μάζα του διαλύματος. Αυτό το χαρακτηριστικό είναι πλεονεκτικό για τον ακριβή προσδιορισμό της ωσμωτικότητας σε οποιαδήποτε κατάσταση θερμοκρασίας και πίεσης.
Η ωσμωτικότητα μπορεί εύκολα να προσδιοριστεί με τη μέθοδο της κατάθλιψης σημείου πήξης. Βασίζεται στην έμμεση αναλογικότητα των διαλυμένων ουσιών και στο σημείο πήξης του διαλύματος (όσο περισσότερη διαλυμένη ουσία σε ένα διάλυμα, τόσο χαμηλότερο θα είναι το σημείο πήξης του)
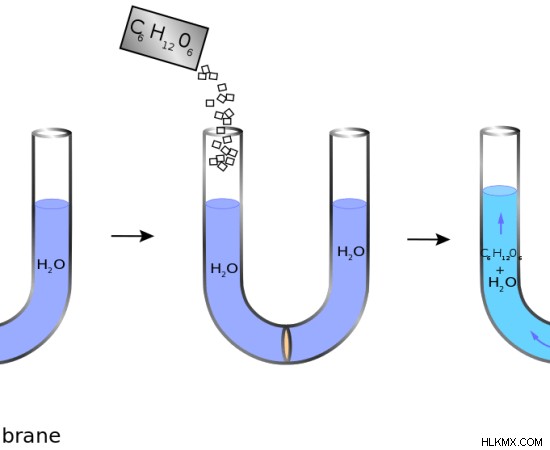
Εικόνα 2:Η οσμωτική πίεση προκύπτει όταν μια ένωση διαλύεται σε νερό.
Η μονάδα για την ωσμωτικότητα είναι osmol/kg. Η ωσμωτικότητα δίνει τη συγκέντρωση μιας διαλυμένης ουσίας σε ένα διάλυμα ως προς τη μάζα του διαλύματος.
Σχέση μεταξύ ωσμωτικότητας και ωσμωτικότητας
- Για πολύ αραιά διαλύματα, η ωσμωτικότητα και η ωσμωτικότητα είναι αριθμητικά τα ίδια.
- Η διαφορά μεταξύ ωσμωτικότητας και ωσμωτικότητας ονομάζεται ωσμωτικό χάσμα.
Διαφορά μεταξύ ωσμωτικότητας και ωσμωτικότητας
Ορισμός
Οσμωτικότητα: Οσμωτικότητα είναι η συγκέντρωση ενός διαλύματος που εκφράζεται ως οσμόριο σωματιδίων διαλυμένης ουσίας ανά λίτρο διαλύματος.
Οσμωτικότητα: Οσμωτικότητα είναι η συγκέντρωση ενός διαλύματος που εκφράζεται ως ο συνολικός αριθμός σωματιδίων διαλυμένης ουσίας ανά χιλιόγραμμο.
Υπολογισμός
Οσμωτικότητα: Η ωσμωτικότητα υπολογίζεται λαμβάνοντας υπόψη τον όγκο του διαλύματος.
Οσμωτικότητα: Η ωσμωτικότητα υπολογίζεται λαμβάνοντας υπόψη τη μάζα του διαλύματος
Μονάδες
Οσμωτικότητα: Οι μονάδες για την ωσμωτικότητα είναι mol/L.
Οσμωτικότητα: Οι μονάδες για την ωσμωτικότητα είναι το osmol/L.
Θερμοκρασία και πίεση
Οσμωτικότητα: Η ωσμωτικότητα εξαρτάται από τη θερμοκρασία και την πίεση.
Οσμωτικότητα: Η ωσμωτικότητα δεν εξαρτάται από τη θερμοκρασία και την πίεση.
Συμπέρασμα
Τόσο η ωσμωτικότητα όσο και η ωσμωτικότητα χρησιμοποιούνται για τον προσδιορισμό της οσμωτικής πίεσης ενός συστήματος. Περιγράφουν τη συγκέντρωση ενός διαλύματος σε ωσμόλη. Ωστόσο, έχουν κάποιες διαφορές όπως συζητήθηκε παραπάνω σε αυτό το άρθρο. Η κύρια διαφορά μεταξύ της ωσμωτικότητας και της ωσμωτικότητας είναι ότι η ωσμωτικότητα μετριέται λαμβάνοντας υπόψη τον όγκο ενός διαλύματος ενώ η ωσμωτικότητα μετράται λαμβάνοντας υπόψη τη μάζα ενός διαλύματος.




