Ποιος είναι ο δεύτερος νόμος της θερμοδυναμικής;
Ο δεύτερος νόμος της θερμοδυναμικής δηλώνει ότι, σε μια αυθόρμητη διαδικασία, η συνολική εντροπία του σύμπαντος πάντα αυξάνεται.
Μπορεί ένας θερμικός κινητήρας να λειτουργεί με 100% απόδοση; Το έτος 1824, ο επιστήμονας Nicolas Léonard Sadi Carnot, γνωστός και ως πατέρας της θερμοδυναμικής, προσπάθησε να βρει την απάντηση. Σε ένα από τα θεωρητικά του μοντέλα, τοποθέτησε έναν κύλινδρο με ένα έμβολο ανάμεσα σε δύο δεξαμενές θερμότητας. Και οι δύο δεξαμενές ήταν σε σταθερή θερμοκρασία, αλλά η μία είχε θερμοκρασία υψηλότερη από την άλλη.
Η ιδέα ήταν να μετατραπεί η ροή θερμότητας μεταξύ των δύο δεξαμενών σε έργο. Για να το κάνει αυτό, τοποθέτησε έναν κύλινδρο με ένα έμβολο ανάμεσα στις δεξαμενές. Ωστόσο, συνειδητοποίησε ότι ήταν αδύνατο να επιτύχει 100% αποτελεσματικότητα. Κάποια θερμότητα έρεε πάντα μέσω του κυλίνδρου προς την ψυχρή δεξαμενή.
Ο πρώτος νόμος της θερμοδυναμικής δηλώνει ότι η ενέργεια δεν μπορεί ούτε να δημιουργηθεί ούτε να καταστραφεί. μπορεί να αλλάξει μόνο μορφές. Ωστόσο, έχει ορισμένους περιορισμούς. Δεν καθορίζει την κατεύθυνση προς την οποία μπορεί να συμβεί μια αλλαγή, ούτε λέει αν μια αλλαγή είναι αναστρέψιμη ή όχι. Αν ρίξουμε ένα αντικείμενο από ύψος, η δυναμική ενέργεια μετατρέπεται σε κινητική ενέργεια και πέφτει. Ωστόσο, αφού χτυπήσει στο έδαφος, δεν αναπηδά στο ίδιο ύψος. Γιατί συμβαίνει αυτό; Για να το κατανοήσουμε αυτό, ας δούμε έναν κρίσιμο όρο:Αυθόρμητη διαδικασία .
Αυθόρμητη διαδικασία
Μια αυθόρμητη διαδικασία στη θερμοδυναμική είναι αυτή που μπορεί να συμβεί χωρίς καμία εξωτερική παρέμβαση. Πρέπει επίσης να έχει αρκετό χρόνο για να συμβεί. Βάλτε μια σταγόνα μελάνι σε ένα ποτήρι νερό και απλώνεται σε όλο το ποτήρι «αυθόρμητα», ενώ μια κουταλιά ζάχαρη χρειάζεται λίγο ανακάτεμα για να διαλυθεί σε ένα ποτήρι νερό. Όταν κάνει ζέστη έξω, το δωμάτιό σας θερμαίνεται "αυθόρμητα", αλλά χρειάζεται κλιματιστικό για να κρατήσει το δωμάτιό σας κρύο.

Το μελάνι απλώνεται στο νερό αυθόρμητα
Από την εμπειρία, γνωρίζουμε ότι ορισμένα γεγονότα που συμβαίνουν στη ζωή μας είναι αυθόρμητα. Ωστόσο, οι επιστήμονες χρειάζονταν έναν τρόπο για να ορίσουν τον αυθορμητισμό οποιουδήποτε γεγονότος. Χρειάζονταν έναν τρόπο για να καθορίσουν την κατεύθυνση προς την οποία θα μπορούσε να συμβεί μια αλλαγή. Αυτή η ανάγκη γέννησε αυτό που γνωρίζουμε ως δεύτερος νόμος της θερμοδυναμικής .
Ο δεύτερος νόμος της θερμοδυναμικής
Οι νόμοι της θερμοδυναμικής ορίζουν πώς η εργασία, η θερμότητα και η ενέργεια επηρεάζουν ένα δεδομένο σύστημα. Σύστημα είναι οποιαδήποτε περιοχή στο σύμπαν που είναι πεπερασμένα οριοθετημένη, μέσω της οποίας μεταφέρεται ενέργεια. Οτιδήποτε έξω από αυτό το όριο θεωρείται το περιβάλλον του.
(Φωτογραφία:Wavesmikey / Wikipedia Commons)
Ο δεύτερος νόμος της θερμοδυναμικής λέει ότι, σε μια αυθόρμητη διαδικασία, η συνολική εντροπία του σύμπαντος πάντα αυξάνεται. Ορίζεται επίσης χρησιμοποιώντας τον τύπο:

Εδώ, το S υποδηλώνει την εντροπία του συστήματος. Για να κατανοήσουμε αυτόν τον τύπο, ας δούμε τον όρο:Εντροπία.
Εντροπία
Εάν έχετε ακούσει ποτέ για αυτόν τον όρο, μπορείτε να τον συσχετίσετε με τη «διαταραχή». Ωστόσο, στη θερμοδυναμική, ο ορισμός είναι πιο εξελιγμένος.
Για να μπορέσετε να κατανοήσετε σωστά την Εντροπία, πρέπει να καταλάβετε ότι οι ενέργειες κβαντίζονται. Όταν τα ηλεκτρόνια σε ένα άτομο παίρνουν ενέργεια, την απορροφούν μόνο σε ακέραια πολλαπλάσια μιας μικρής ποσότητας ενέργειας που ονομάζεται "κβάντο".
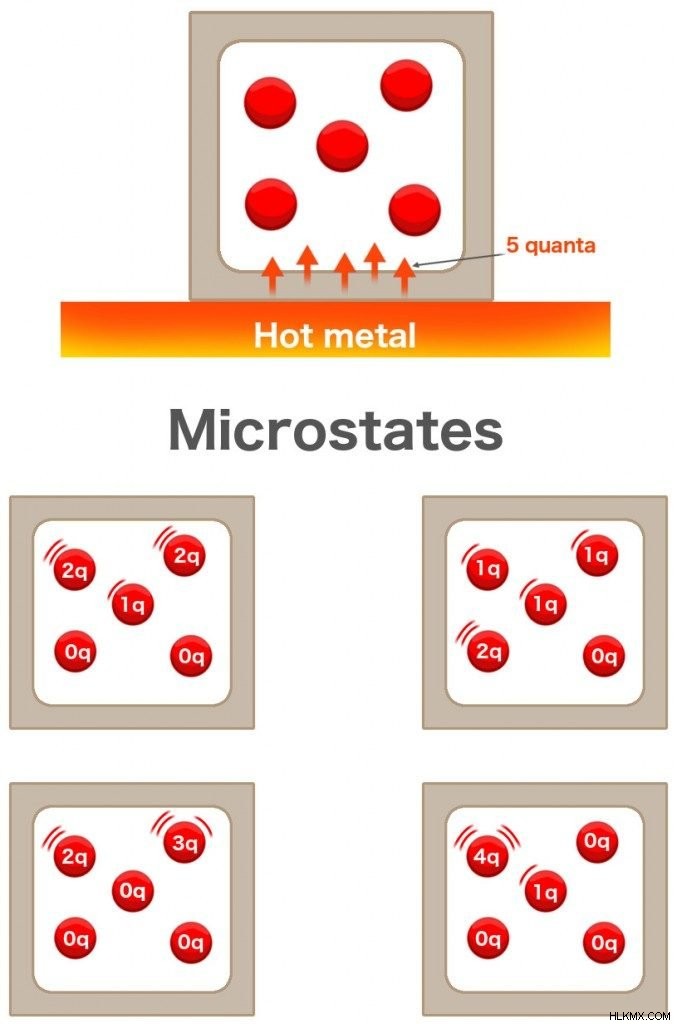
Όταν βάζετε μια σταγόνα μελάνι σε ένα ποτήρι νερό, απλώνεται σε όλο το νερό. Ομοίως, εάν έχετε ένα ζεστό μέταλλο σε ένα τραπέζι, η θερμότητα από αυτό εξαπλώνεται σε όλο το περιβάλλον. Φανταστείτε ότι υπάρχει ένα κουτί που περιέχει 5 μόρια αερίου. Διατηρείται ακριβώς δίπλα σε αυτό το καυτό μέταλλο. Το μέταλλο μεταφέρει 5 κβάντα θερμότητας στο αέριο. Κάθε μόριο αερίου θα πάρει 1 κβάντο ενέργειας το καθένα; Όχι απαραίτητα.

Είναι πιθανό 2 μόρια να πάρουν 2 κβάντα το καθένα και ένα μόριο να πάρει 1 κβάντο, ενώ οι άλλες 2 μονάδες να μην πάρουν κανένα. Είναι επίσης πιθανό ένα μόριο να πάρει 3 κβάντα, ένα άλλο να πάρει 2 και τα άλλα να μην πάρουν κανένα. Μπορούν να υπάρχουν 126 πιθανοί συνδυασμοί, οι οποίοι μπορούν να υπολογιστούν χρησιμοποιώντας τον τύπο:
 Εδώ, N είναι ο αριθμός των μορίων και q είναι τα κβάντα της παρεχόμενης ενέργειας.
Εδώ, N είναι ο αριθμός των μορίων και q είναι τα κβάντα της παρεχόμενης ενέργειας.
Αυτά τα μόρια μπορούν επίσης να προσκρούσουν μεταξύ τους και να ανταλλάξουν την κινητική τους ενέργεια. Ωστόσο, η συνολική ενέργεια δεν μπορεί να υπερβαίνει την ποσότητα ενέργειας που παρέχεται.
Κάθε ένας από αυτούς τους συνδυασμούς ονομάζεται «μικροκατάσταση». Το συνολικό επίπεδο ενέργειας ονομάζεται «μακροκατάσταση». Η εντροπία είναι ένα μέτρο του αριθμού των τρόπων με τους οποίους η ενέργεια μπορεί να διανεμηθεί σε όλα τα μόρια. Επομένως, είναι ένας παράγοντας του αριθμού των «μικροκαταστάσεων ”, αντιπροσωπεύεται επίσης ως Ω.
Η εντροπία είναι μια μεταβλητή κατάστασης. Μια μεταβλητή κατάστασης είναι αυτή που περιγράφει τη φυσική κατάσταση ενός συστήματος, όπως η πίεση, η θερμοκρασία και ο όγκος. Ο μαθηματικός τύπος της εντροπίας είναι:
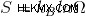
Εδώ, kB είναι η σταθερά Boltzmann. Είναι μια φυσική σταθερά που σημαίνει τη μέση κινητική ενέργεια των σωματιδίων σε ένα αέριο σε σχέση με τη θερμοκρασία. Αυτή η σταθερά πολλαπλασιάζεται στο φυσικό ημερολόγιο του αριθμού των μικροκαταστάσεων για τον υπολογισμό της εντροπίας.
Η μεταβολή της εντροπίας μπορεί επίσης να υπολογιστεί διαιρώντας τη θερμότητα που απορροφάται με τη θερμοκρασία. Η θερμότητα που απορροφάται αυξάνει την κινητική ενέργεια των σωματιδίων. Έτσι, ο τύπος είναι:
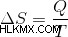
Με λίγα λόγια, η εντροπία είναι ένα μέτρο του αριθμού των τρόπων με τους οποίους η ενέργεια μπορεί να διανεμηθεί σε ένα σύνολο μορίων σε ένα σύστημα.
Υπολογισμός της εντροπίας μιας θερμικής μηχανής
Ας επιστρέψουμε στον κινητήρα του Carnot και ας προσπαθήσουμε να καταλάβουμε πότε είναι δυνατή μια θερμική μηχανή. Ας υποθέσουμε ότι η θερμή δεξαμενή έχει θερμοκρασία TH και η ψυχρή δεξαμενή έχει θερμοκρασία TC. Μια ποσότητα θερμότητας QH εξάγεται από τη θερμή δεξαμενή για να γίνει κάποια εργασία.
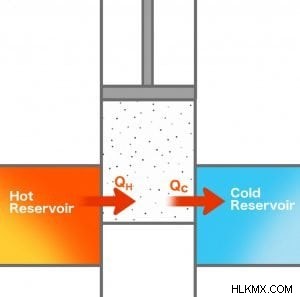
Έτσι, η μεταβολή στην εντροπία της θερμής δεξαμενής είναι:
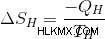
Το Q είναι αρνητικό επειδή εξάγεται θερμότητα από τη δεξαμενή
Καθώς το έμβολο του κινητήρα κάνει τη δουλειά και επανέρχεται στην αρχική του κατάσταση, η αλλαγή στην εντροπία του κινητήρα (  ) είναι 0.
) είναι 0.
Αν υποθέσουμε ότι όλη η ενέργεια καταναλώνεται για να γίνει η εργασία και δεν δίνεται θερμότητα στην ψυχρή δεξαμενή, τότε η εντροπία της ψυχρής δεξαμενής ( 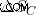 ) είναι επίσης 0.
) είναι επίσης 0.
Ετσι, 
 Η συνολική εντροπία του σύμπαντος γίνεται αρνητική και επομένως δεν μπορεί να είναι αυθόρμητη.
Η συνολική εντροπία του σύμπαντος γίνεται αρνητική και επομένως δεν μπορεί να είναι αυθόρμητη.
Τώρα, ας υποθέσουμε ότι η κρύα δεξαμενή απορροφά μια ποσότητα θερμότητας QC και δεν χρησιμοποιείται για να κάνει καμία εργασία. Σε αυτή την περίπτωση, η εντροπία της ψυχρής δεξαμενής ( 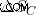 ) είναι
) είναι 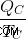
Σε αυτή την περίπτωση, 
Η μόνη περίπτωση που ο κινητήρας μπορεί να λειτουργήσει είναι όταν το 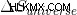 είναι θετικό ή
είναι θετικό ή  είναι θετικό, όπως δηλώνεται από τον δεύτερο νόμο της θερμοδυναμικής.
είναι θετικό, όπως δηλώνεται από τον δεύτερο νόμο της θερμοδυναμικής.
Στα τέλη του 19ου αιώνα, ο Λόρδος Κέλβιν και ο Μαξ Πλανκ είχαν αυτές τις παρατηρήσεις. Δήλωσαν:«Δεν μπορεί κανείς να μετατρέψει μια ποσότητα θερμότητας εντελώς σε εργασία χωρίς να σπαταλήσει μέρος αυτής της θερμότητας σε χαμηλότερη θερμοκρασία». Αυτή η δήλωση είναι επίσης μια εναλλακτική πρόταση για τον δεύτερο νόμο της θερμοδυναμικής.
Ο καθολικός νόμος
Ο Άλμπερτ Αϊνστάιν ήταν αρκετά άπταιστα στη σύνθετη γλώσσα της θερμοδυναμικής. Μάλιστα, δημοσίευσε αρκετές εργασίες για το θέμα. Κάποτε ανέφερε:«Μια θεωρία είναι πιο εντυπωσιακή όσο μεγαλύτερη είναι η απλότητα των υποθέσεών της, τόσο περισσότερα διαφορετικά είδη πραγμάτων σχετίζεται και όσο πιο εκτεταμένη είναι η περιοχή εφαρμογής της. Επομένως, η βαθιά εντύπωση που μου έκανε η κλασική θερμοδυναμική. Είναι η μόνη φυσική θεωρία καθολικού περιεχομένου που είμαι πεπεισμένος ότι δεν θα ανατραπεί ποτέ, στο πλαίσιο της εφαρμοσιμότητας των βασικών της εννοιών.»
Ο δεύτερος νόμος της θερμοδυναμικής οδηγεί το σύμπαν. Γνωρίζουμε ότι το σύμπαν διαστέλλεται. Σύμφωνα με τον δεύτερο νόμο της θερμοδυναμικής, η εντροπία του σύμπαντος πρέπει επίσης να αυξηθεί. Τα αστέρια είναι η πηγή ενέργειας για το σύμπαν. Μέχρι τη στιγμή που το τελευταίο αστέρι εκπέμπει το τελικό του φωτόνιο, το επίπεδο εντροπίας θα είναι απίστευτα υψηλό. Μην ανησυχείτε… όλοι θα είχαμε χαθεί πολύ πριν από αυτή τη φορά. Τότε θα πεθάνει το σύμπαν, καθώς δεν θα μείνει ενέργεια για να αυξηθεί η εντροπία του σύμπαντος!
Διαβάστε περισσότερα:
Τι είναι ο Πρώτος Νόμος της Θερμοδυναμικής;
Τι είναι ο Τρίτος Νόμος της Θερμοδυναμικής;