Διαφορά μεταξύ βουτανίου και ισοβουτανίου
Κύρια διαφορά – Βουτάνιο εναντίον Ισοβουτάνιο
Το βουτάνιο είναι μια οργανική ένωση. Αυτό το μόριο μπορεί να βρεθεί σε διάφορες μορφές γνωστές ως ισομερή. Το ισοβουτάνιο είναι ένα δομικό ισομερές του βουτανίου. Τόσο το βουτάνιο όσο και το ισοβουτάνιο είναι αέριες ενώσεις υδρογονάνθρακα. Είναι υδρογονάνθρακες επειδή αυτές οι ενώσεις αποτελούνται μόνο από άτομα C και H. Τόσο το βουτάνιο όσο και το ισοβουτάνιο έχουν τον ίδιο χημικό τύπο:C4 H10 . Επομένως, έχουν τις ίδιες τιμές μοριακής μάζας. Αυτές οι ενώσεις είναι εύφλεκτες και έτσι μπορούν να χρησιμοποιηθούν ως καύσιμο για καύση. Η κύρια διαφορά μεταξύ βουτανίου και ισοβουτανίου είναι ότι το βουτάνιο μπορεί να είναι είτε γραμμικό είτε διακλαδισμένο μόριο ενώ το ισοβουτάνιο είναι ουσιαστικά ένα διακλαδισμένο μόριο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το βουτάνιο
– Ορισμός, ιδιότητες και εφαρμογές
2. Τι είναι το Ισοβουτάνιο
– Ορισμός, ιδιότητες και εφαρμογές
3. Ποιες είναι οι ομοιότητες μεταξύ βουτανίου και ισοβουτανίου
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ βουτανίου και ισοβουτανίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Βουτάνιο, Καύσιμο, Ισοβουτάνιο, Ισομερή, Υδρογονάνθρακας 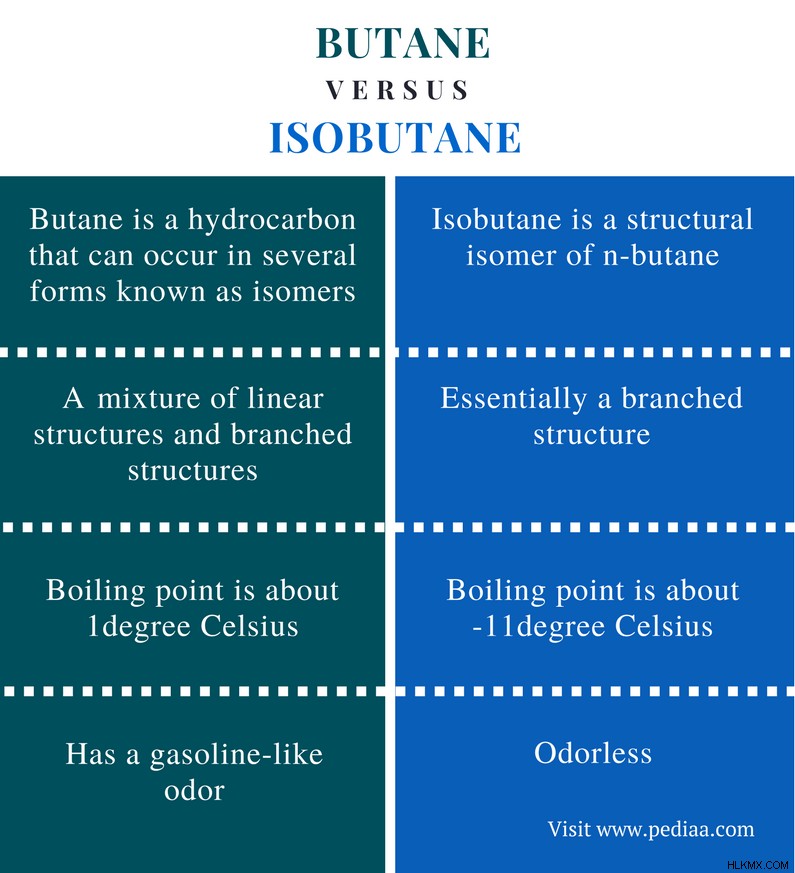
Τι είναι το βουτάνιο
Το βουτάνιο είναι ένας υδρογονάνθρακας που μπορεί να εμφανιστεί σε διάφορες μορφές γνωστές ως ισομερή. Ο χημικός τύπος του βουτανίου είναι C4 H10 . Είναι αλκάνιο αφού δεν υπάρχουν διπλοί δεσμοί μεταξύ των ατόμων άνθρακα. Η μοριακή μάζα του βουτανίου είναι περίπου 58 g/mol. Σε θερμοκρασία δωματίου και ατμοσφαιρική πίεση, το βουτάνιο είναι ένα άχρωμο αέριο που έχει οσμή βενζίνης.
Η κύρια πηγή βουτανίου είναι το αργό πετρέλαιο. Το αργό πετρέλαιο έχει ως δευτερεύον συστατικό βουτάνιο. Το βουτάνιο είναι επίσης υποπροϊόν της διύλισης πετρελαίου. Μπορεί να εμφανιστεί σε διάφορες ισομερείς μορφές. Αυτά τα ισομερή ονομάζονται δομικά ισομερή. Υπάρχουν δύο ισομερή του βουτανίου:το ν-βουτάνιο και το ισοβουτάνιο. Το n-βουτάνιο είναι η γραμμική, ευθεία αλυσίδα του βουτανίου. Το ισοβουτάνιο είναι η διακλαδισμένη δομή του βουτανίου. Ο όρος βουτάνιο μπορεί να χρησιμοποιηθεί για να περιγράψει ένα από αυτά τα ισομερή ή ένα μείγμα αυτών.
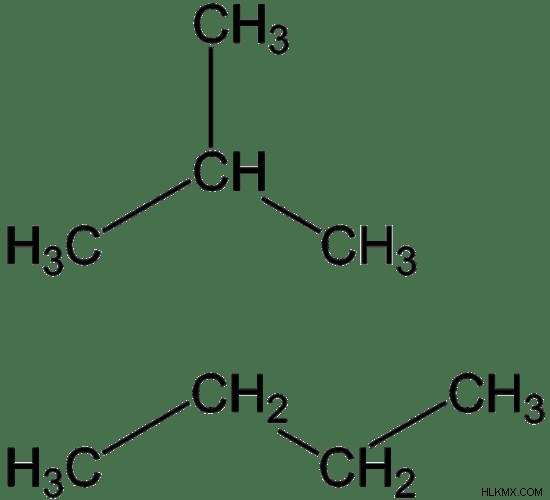
Εικόνα 1:Δύο ισομερή βουτανίου. Ισοβουτάνιο (πάνω) και ν-βουτάνιο (κάτω)
Το βουτάνιο μπορεί να καεί παρουσία οξυγόνου. Αυτό συμβαίνει επειδή το βουτάνιο είναι πολύ εύφλεκτο. Εάν υπάρχει αρκετό οξυγόνο, το βουτάνιο υφίσταται πλήρη καύση. Εάν δεν υπάρχει αρκετό οξυγόνο, το βουτάνιο θα υποστεί ατελή καύση. Και στις δύο περιπτώσεις, η καύση παράγει θερμική ενέργεια.
Το βουτάνιο μπορεί να χρησιμοποιηθεί ως ενισχυτικό για την εξάτμιση της βενζίνης. Επομένως, το βουτάνιο είναι μερικές φορές πρόσθετο στη βενζίνη. Το βουτάνιο μπορεί επίσης να χρησιμοποιηθεί απευθείας ως καύσιμο. Για παράδειγμα, μπορεί εύκολα να υγροποιηθεί και να πωληθεί για οικιακούς σκοπούς όπως το μαγείρεμα. Δεδομένου ότι το σημείο βρασμού του βουτανίου είναι 1 C ή λιγότερο, το υγρό βουτανίου θα εξατμιστεί αμέσως σε θερμοκρασία δωματίου.
Τι είναι το ισοβουτάνιο
Το ισοβουτάνιο είναι ένα δομικό ισομερές του ν-βουτανίου. Ο χημικός τύπος του ισοβουτανίου είναι C4 H10 . Η μοριακή μάζα του ισοβουτανίου είναι περίπου 58 g/mol. Είναι ένα αλκάνιο που έχει διακλαδισμένη δομή. Εδώ, τρεις ομάδες μεθυλίου και ένα άτομο Η συνδέονται με ένα κεντρικό άτομο άνθρακα. Η γεωμετρία γύρω από το κεντρικό άτομο άνθρακα του ισοβουτανίου είναι τετραεδρική. Το ισοβουτάνιο είναι επίσης ένα άχρωμο αέριο σε θερμοκρασία δωματίου και ατμοσφαιρική πίεση. Σε αντίθεση με το ν-βουτάνιο, είναι ένα άοσμο αέριο.

Εικόνα 02:Μοντέλο σφαιρών και ραβδιών ισοβουτανίου
Το ισοβουτάνιο έχει πολύ χαμηλό σημείο βρασμού από αυτό του κανονικού βουτανίου. Το σημείο βρασμού του ισοβουτανίου είναι περίπου -11C. Ο λόγος για αυτή τη διαφορά είναι η διακλαδισμένη δομή του ισοβουτανίου. Ένα γραμμικό μόριο μπορεί να έχει περισσότερες δυνάμεις Van Der Waal από αυτές ενός διακλαδισμένου μορίου. (Η επιφάνεια μιας γραμμικής δομής είναι μεγαλύτερη από την επιφάνεια ενός διακλαδισμένου μορίου, επιτρέποντάς της να έχει περισσότερες δυνάμεις Van Der Waal μεταξύ των μορίων.). Η παρουσία ασθενούς ή μικρότερης ποσότητας δυνάμεων Van Der Waal καθιστά ευκολότερο τον διαχωρισμό των μορίων το ένα από το άλλο. Επομένως, το σημείο βρασμού μειώνεται.
Λόγω της διαφοράς στη χωρική διάταξη των ατόμων του ισοβουτανίου, οι χημικές και φυσικές ιδιότητες είναι διαφορετικές από αυτές του βουτανίου. Το ισοβουτάνιο μπορεί να σχηματιστεί από τον ισομερισμό του η-βουτανίου. Είναι καταλυτική αντίδραση και είναι αναστρέψιμη. Αυτός ο ισομερισμός γίνεται μέσω ενός ενδιάμεσου που λέγεται ολεφίνες. Η αποτελεσματικότητα της διαδικασίας εξαρτάται από τη θερμοκρασία του συστήματος.
Το ισοβουτάνιο χρησιμοποιείται ως ψυκτικό μέσο. Δεδομένου ότι έχει αμελητέα επίδραση στη στιβάδα του όζοντος, το ισοβουτάνιο είναι καλός υποκαταστάτης για ενώσεις όπως ο χλωροφθοράνθρακας που χρησιμοποιούνται στα ψυγεία.
Ομοιότητες μεταξύ βουτανίου και ισοβουτανίου
- Το βουτάνιο και το ισοβουτάνιο είναι ενώσεις υδρογονάνθρακα.
- Και τα δύο έχουν τον ίδιο χημικό τύπο.
- Και τα δύο έχουν την ίδια μοριακή μάζα.
- Και οι δύο ενώσεις αποτελούνται από sp υβριδισμένα άτομα άνθρακα.
- Και τα δύο είναι άχρωμα αέρια σε θερμοκρασία δωματίου και ατμοσφαιρική πίεση.
Διαφορά μεταξύ βουτανίου και ισοβουτανίου
Ορισμός
Βουτάνιο: Το βουτάνιο είναι ένας υδρογονάνθρακας που μπορεί να εμφανιστεί σε διάφορες μορφές ως ισομερή.
Ισοβουτάνιο: Το ισοβουτάνιο είναι ένα δομικό ισομερές του ν-βουτανίου.
Χημική δομή
Βουτάνιο: Το βουτάνιο είναι ένα μείγμα γραμμικών δομών και διακλαδισμένων δομών.
Ισοβουτάνιο: Το ισοβουτάνιο είναι ουσιαστικά μια διακλαδισμένη δομή.
Σημείο βρασμού
Βουτάνιο: Το σημείο βρασμού του βουτανίου είναι περίπου 1C.
Ισοβουτάνιο: Το σημείο βρασμού του ισοβουτανίου είναι περίπου -11 C.
Οσμή
Βουτάνιο: Το βουτάνιο έχει οσμή βενζίνης.
Ισοβουτάνιο: Το ισοβουτάνιο είναι άοσμο.
Συμπέρασμα
Το βουτάνιο και το ισοβουτάνιο είναι ενώσεις υδρογονανθράκων που μπορούν να βρεθούν στο αργό πετρέλαιο ως δευτερεύοντα συστατικά. Είναι μικρές ενώσεις αλκανίων που ονομάζονται παραφινικό κλάσμα διύλισης πετρελαίου. Αν και έχουν τον ίδιο χημικό τύπο και την ίδια μοριακή μάζα, διαφέρουν με διάφορους τρόπους. Η κύρια διαφορά μεταξύ βουτανίου και ισοβουτανίου είναι ότι το βουτάνιο μπορεί να είναι είτε γραμμικό είτε διακλαδισμένο μόριο ενώ το ισοβουτάνιο είναι ουσιαστικά ένα διακλαδισμένο μόριο.
Αναφορές:
1. "Βουτάνιο:Ορισμός, Ιδιότητες &Τύπος." Study.com, Study.com, Διαθέσιμο εδώ. Πρόσβαση στις 23 Αυγούστου 2017.
2. "NIST Chemistry WebBook, SRD 69." Ισοβουτάνιο, Εθνικό Ινστιτούτο Προτύπων και Τεχνολογίας, Διαθέσιμο εδώ. Πρόσβαση στις 23 Αυγούστου 2017.
Ευγενική προσφορά εικόνας
1. «Isobutane-3D-balls» των Ben Mills και Jynto – Παράγωγο του File:Neopentane-3D-balls.png και File:Methane-3D-balls.png. (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Isobutane-n-butane" (Δημόσιος Τομέας) μέσω Commons Wikimedia




