Διαφορά μεταξύ Αιθέρα και Κετόνης
Κύρια διαφορά – Αιθέρας εναντίον κετόνης
Οι αιθέρες και οι κετόνες είναι δύο διαφορετικές ομάδες οργανικών ενώσεων. Έχουν διαφορετικές χημικές και φυσικές ιδιότητες. Αλλά και οι δύο αυτές ενώσεις αποτελούνται ουσιαστικά από άτομα C, H και O. Για την ταυτοποίηση αυτών των ενώσεων, χρησιμοποιούνται οι λειτουργικές τους ομάδες. Με άλλα λόγια, μια κετόνη μπορεί να διακριθεί από έναν αιθέρα προσδιορίζοντας τις λειτουργικές τους ομάδες. Μια λειτουργική ομάδα είναι μια ομάδα ατόμων που καθορίζει τις χημικές ιδιότητες ενός μορίου. Μπορούμε να αναγνωρίσουμε τη διαφορά μεταξύ αιθέρα και κετόνης σύμφωνα με τις λειτουργικές τους ομάδες. Η κύρια διαφορά μεταξύ αιθέρα και κετόνης είναι ότι η λειτουργική ομάδα του αιθέρα αποτελείται από δύο άτομα άνθρακα συνδεδεμένα με το ίδιο άτομο οξυγόνου, ενώ η λειτουργική ομάδα της κετόνης αποτελείται από ένα άτομο οξυγόνου που συνδέεται με ένα άτομο άνθρακα μέσω ενός διπλού δεσμού .
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο Αιθέρας
– Ορισμός, ιδιότητες και κοινές αντιδράσεις των αιθέρων
2. Τι είναι το Ketone
– Ορισμός, ιδιότητες και κοινές αντιδράσεις των κετονών
3. Ποια είναι η διαφορά μεταξύ Αιθέρα και Κετόνης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αιθέρας, Λειτουργική ομάδα, Κετόνη 
Τι είναι ο Αιθέρας
Οι αιθέρες είναι οργανικές ενώσεις που έχουν τον γενικό τύπο R-O-R’. Εδώ, το άτομο οξυγόνου συνδέεται με δύο ομάδες αλκυλίου ή αρυλίου. Αυτό σημαίνει ότι το άτομο οξυγόνου είναι ουσιαστικά συνδεδεμένο με δύο άτομα άνθρακα. Η παρουσία αυτής της δομής C-O-C υποδηλώνει την παρουσία μιας ομάδας αιθέρα. Επομένως, ενεργεί ως η λειτουργική ομάδα του αιθέρα. Αυτή η λειτουργική ομάδα καθορίζει τις χημικές ιδιότητες και τις αντιδράσεις που υφίστανται οι αιθέρες.
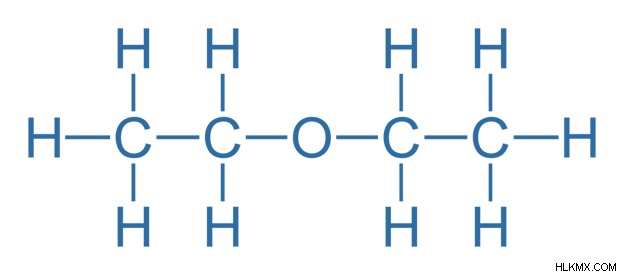
Εικόνα 1:Διαιθυλαιθέρας
Σε θερμοκρασία δωματίου, οι αιθέρες είναι υγρά με γλυκιά οσμή. Τα μόρια του αιθέρα δεν μπορούν να σχηματίσουν δεσμούς υδρογόνου επειδή δεν υπάρχουν ομάδες –ΟΗ αφού το άτομο οξυγόνου είναι συνδεδεμένο με δύο άλλα άτομα άνθρακα. Αυτό κάνει τους αιθέρες να έχουν χαμηλότερα σημεία βρασμού από αυτό των αντίστοιχων αλκοολών και άλλων οργανικών ενώσεων. Επομένως, οι αιθέρες είναι εξαιρετικά πτητικές και εύφλεκτες. Οι αιθέρες είναι επίσης λιγότερο διαλυτοί στο νερό για τον ίδιο λόγο. Όμως, το άτομο οξυγόνου του μορίου του αιθέρα έχει μεμονωμένα ζεύγη ηλεκτρονίων και τα άτομα υδρογόνου των μορίων του νερού έχουν μερικό θετικό φορτίο. Επομένως, οι αιθέρες μπορούν να δημιουργήσουν δεσμούς υδρογόνου με μόρια νερού.
Αν και η λειτουργική ομάδα του αιθέρα είναι αδρανής ως προς τις περισσότερες χημικές αντιδράσεις, υπάρχουν ορισμένες κοινές αντιδράσεις στις οποίες μπορούν να υποστούν οι αιθέρες. Αυτή η αδράνεια είναι χρήσιμη στη χρήση τους ως διαλύτες. Ο πιο κοινός τύπος αντίδρασης που παρουσιάζουν οι αιθέρες είναι η αντίδραση διάσπασης. Εδώ, ένας δεσμός C-O διασπάται από ισχυρά οξέα. Εκτός από αυτό, παρουσία αέρα και οξυγόνου, οι αιθέρες σχηματίζουν εκρηκτικά υπεροξείδια.
Τι είναι η κετόνη
Η κετόνη είναι μια οργανική ένωση με τον γενικό τύπο R-C (=O)-R’. Εδώ, το άτομο οξυγόνου συνδέεται με ένα άτομο άνθρακα μέσω ενός διπλού δεσμού. Αυτό το άτομο άνθρακα συνδέεται και πάλι με δύο άλλες ομάδες αλκυλίου ή αρυλίου. Αυτή η δομή λειτουργεί ως η λειτουργική ομάδα της κετόνης. Αυτό το άτομο άνθρακα είναι υβριδισμένο sp. Επομένως, έχει μόνο τρεις δεσμούς σίγμα γύρω του. Η γεωμετρία γύρω από αυτό το άτομο άνθρακα είναι επίπεδη.
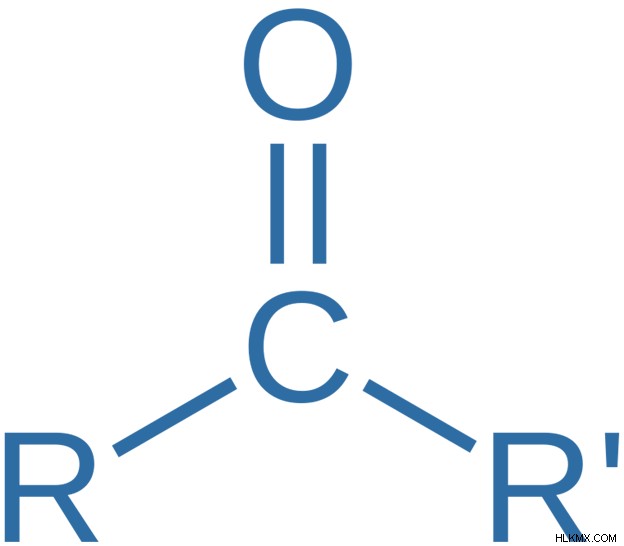
Εικόνα 2:Η Γενική Δομή των Κετόνων
Οι κετόνες είναι πολικά μόρια επειδή ο διπλός δεσμός –C=O είναι πολικός. Η ηλεκτραρνητικότητα του ατόμου C είναι υψηλότερη από το άτομο Ο. Τότε τα ηλεκτρόνια του δεσμού έλκονται πολύ από το άτομο οξυγόνου παρά από το άτομο άνθρακα. Αυτό έχει ως αποτέλεσμα ένα μερικό αρνητικό φορτίο στο άτομο οξυγόνου και ένα μερικό θετικό φορτίο στο άτομο άνθρακα, καθιστώντας το μόριο της κετόνης μια πολική ένωση. Αν και τα μόρια κετόνης δεν μπορούν να σχηματίσουν δεσμούς υδρογόνου μεταξύ τους, αυτά τα μόρια σχηματίζουν δεσμούς υδρογόνου με μόρια νερού. Δεδομένου ότι το άτομο οξυγόνου του μορίου της κετόνης είναι πλούσιο σε ηλεκτρόνια και τα άτομα υδρογόνου των μορίων του νερού έχουν μερικώς θετικά φορτία πάνω τους, το άτομο οξυγόνου μπορεί να σχηματίσει δεσμούς υδρογόνου με αυτά τα άτομα υδρογόνου. Επομένως, οι κετόνες είναι διαλυτές στο νερό.
Ο δεσμός –C=O είναι εξαιρετικά πολικός. Αυτό κάνει το άτομο άνθρακα μερικώς θετικά φορτισμένο. Στη συνέχεια, αυτό το άτομο άνθρακα μπορεί να προσβληθεί από πυρηνόφιλα. Το είδος της αντίδρασης που λαμβάνει χώρα εδώ ονομάζεται αντίδραση πυρηνόφιλης προσθήκης. Υπάρχουν πολλές άλλες αντιδράσεις που περιλαμβάνουν κετόνες ως αντιδρώντα. Για παράδειγμα, η αντίδραση Grignard μπορεί να συμβεί παρουσία μιας κετόνης και του αντιδραστηρίου Grignard. Αυτή η αντίδραση μετατρέπει μια κετόνη σε αλκοόλη.
Διαφορά μεταξύ αιθέρα και κετόνης
Ορισμός
Αιθέρας: Οι αιθέρες είναι οργανικές ενώσεις που έχουν τον γενικό τύπο R-O-R’.
Κετόνη: Οι κετόνες είναι οργανικές ενώσεις που έχουν τον γενικό τύπο R-C (=O)-R’.
Λειτουργική ομάδα
Αιθέρας: Η λειτουργική ομάδα των αιθέρων έχει ένα άτομο οξυγόνου συνδεδεμένο με δύο άτομα άνθρακα.
Κετόνη: Η λειτουργική ομάδα των κετονών έχει ένα άτομο οξυγόνου συνδεδεμένο με ένα άτομο άνθρακα.
Σύνδεση μεταξύ άνθρακα και οξυγόνου
Αιθέρας: Οι αιθέρες έχουν μονούς δεσμούς -C-O.
Κετόνη: Οι κετόνες έχουν διπλούς δεσμούς -C=O.
Υβριδισμός ατόμων άνθρακα
Αιθέρας: Οι αιθέρες μπορεί να έχουν ή να μην έχουν sp υβριδισμένα άτομα άνθρακα.
Κετόνη: Οι κετόνες έχουν ουσιαστικά ένα sp υβριδισμένο άτομο άνθρακα ανά μόριο.
Πολικότητα
Αιθέρας: Οι αιθέρες είναι λιγότερο πολικοί.
Κετόνη: Οι κετόνες είναι εξαιρετικά πολικές.
Συμπέρασμα
Οι οργανικές ενώσεις αποτελούνται ουσιαστικά από άτομα άνθρακα και υδρογόνου μαζί με κάποια άλλα στοιχεία. Οι αιθέρες και οι κετόνες είναι επίσης οργανικές ενώσεις. Αποτελούνται από άτομα C, H και O. Ένας αιθέρας μπορεί να διακριθεί από μια κετόνη προσδιορίζοντας τις λειτουργικές τους ομάδες. Επομένως, η κύρια διαφορά μεταξύ αιθέρα και κετόνης είναι ότι ένας αιθέρας αποτελείται από λειτουργική ομάδα R-O-R' ενώ μια κετόνη είναι μια ένωση που αποτελείται από -R-C(=O)-R' λειτουργική ομάδα.




