Υβριδισμός:Ορισμός, Τύποι, Κανόνες &Συχνές Ερωτήσεις
Υβριδισμός
Έχετε αναρωτηθεί ποτέ γιατί διαφορετικά μόρια ή ενώσεις παρουσιάζουν διαφορετικά σχήματα; Γιατί οι δεσμοί μεταξύ του κεντρικού ατόμου και άλλων ατόμων σχηματίζονται με συγκεκριμένο τρόπο; Ποια είναι η έννοια που αλλάζει τη γεωμετρία και τη χωρική διάταξη των μορίων;
Είναι κρίσιμο για τη διευθέτηση των σχημάτων, της ενέργειας, κ.λπ. διαφορετικών μορίων. Τώρα, τι είναι ο υβριδισμός και πώς τακτοποιεί τους δεσμούς; Αυτό το άρθρο θα απαντήσει σε αυτές τις ερωτήσεις.
Τι είναι ο υβριδισμός;
Είναι η υπόθεση της ανάμειξης ατομικών τροχιακών για να σχηματιστούν προηγμένα υβριδικά τροχιακά κατάλληλα για την περιγραφή των ιδιοτήτων σύνδεσης. Οδηγεί στο εντελώς νέο σχήμα και προσανατολισμό των τροχιακών σθένους ενός ατόμου.
Είναι ουσιαστικά μια προσπάθεια να προβλέψουμε πού βρίσκονται τα ηλεκτρόνια όταν υπάρχουν δεσμοί και μόνα ζεύγη. Εμφανίζεται όταν τα ατομικά τροχιακά αναμειγνύονται για να σχηματίσουν νέα ατομικά τροχιακά. Τα προηγμένα τροχιακά έχουν ίση χωρητικότητα ηλεκτρονίων με τα παλιά. Οι ενέργειες και οι ιδιότητες των νέων και των υβριδοποιημένων τροχιακών είναι ο «μέσος όρος» των αρχικών μη υβριδοποιημένων τροχιακών.
Η ανάγκη εισαγωγής της έννοιας του υβριδισμού ήταν η καλύτερη εξήγηση για τη βεβαιότητα ότι όλοι οι δεσμοί C-H σε μόρια όπως το μεθάνιο ήταν δυσδιάκριτοι.
Έννοια του υβριδισμού
Ο Linus Pauling εισήγαγε την έννοια του υβριδισμού. Αυτή η έννοια περιγράφει τα χαρακτηριστικά σχήματα διαστάσεων των μορίων με περισσότερα από δύο άτομα όπως το CH4 , H2 O, NH3 κ.λπ. Πρότεινε να ενσωματωθούν τα ατομικά τροχιακά για να σχηματίσουν ένα νέο σύνολο πανομοιότυπων τροχιακών που αναγνωρίζονται ως υβριδικά τροχιακά. Διαφορετικά από τα καθαρά τροχιακά, τα μικτά τροχιακά χρησιμοποιούνται για το σχηματισμό του δεσμού. Ένα τέτοιο επεισόδιο αναγνωρίζεται ως υβριδισμός. Αυτή η διαδικασία μπορεί να είναι η ανάμειξη των τροχιακών ελαφρώς διαφορετικών ενεργειών για την ανακατανομή τους, με αποτέλεσμα το σχηματισμό ενός νέου συνόλου τροχιακών ισοδύναμων ενεργειών και σχημάτων.
Τύποι υβριδισμού
Υπάρχουν διάφοροι τύποι υβριδισμού που περιλαμβάνουν τροχιακά s, p και d. Οι διαφορετικοί τύποι είναι οι παρακάτω:
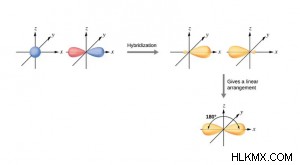
- sp υβριδισμός:
- Ένα p και ένα s αναμειγνύονται τροχιακά, σχηματίζοντας δύο sp σύνθετα (ή υβριδικά) τροχιακά.
- Είναι ισοδύναμα και συμμετρικά υβριδικά τροχιακά.
- Κάθε υβριδικά τροχιακά sp έχει ίσο χαρακτήρα, δηλαδή 50% χαρακτήρα s και 50% χαρακτήρα p.
- Τα μόρια που σχηματίζονται είναι γραμμικά στη γεωμετρία και επομένως έχουν γωνία δεσμού 180°.
- το s-τροχιακό είναι σφαιρικό και το p-τροχιακό έχει σχήμα αχλαδιού, αλλά το υβριδικό τροχιακό sp, που προκύπτει από την ανάμειξη του s και του p τροχιακού, έχει οβάλ σχήμα.
- Αυτός ο τύπος υβριδισμού είναι επίσης γνωστός ως διαγώνιος υβριδισμός, δηλαδή, η χωρική διάταξη κατευθύνεται σε ευθεία γραμμή σε αντίθετες κατευθύνσεις.
- Παράδειγμα:BeCl2 , BeF2 , C2 H2 , BeH2 , κ.λπ.
- sp υβριδισμός:
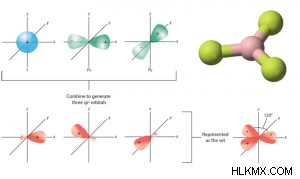
- Ένα s και δύο p αναμειγνύονται, σχηματίζοντας τρία sp συγχωνευμένα (ή υβριδικά) τροχιακά.
- Ονομάζεται επίσης τριγωνικός υβριδισμός.
- Έχουν το ίδιο σχήμα και την ίδια ενέργεια.
- Βρίσκονται σε ένα επίπεδο.
- Κάθε sp Το υβριδικό τροχιακό έχει 33% χαρακτήρα s και 66% χαρακτήρα p.
- Τα μόρια που σχηματίζονται είναι τριγωνικά επίπεδα γεωμετρίας και επομένως έχουν γωνία δεσμού 120°.
- sp Το υβριδικό τροχιακό λαμβάνεται από την ανάμειξη s και δύο τροχιακών p. Ως εκ τούτου, έχει μια τριγωνική χωρική διάταξη.
- Καθώς η συμβολή του p-τροχιακού είναι μεγαλύτερη από το s-τροχιακό, το σχήμα του sp Τα υβριδικά τροχιακά, επομένως, τείνουν περισσότερο προς το αχλάδι.
- Παράδειγμα:BeH3 , BeF3 , κ.λπ., και αλκένια
- sp υβριδισμός:
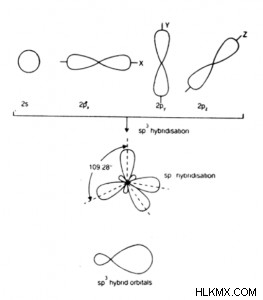
- Ένα s και τρία τροχιακά p αναμειγνύονται για να σχηματίσουν τέσσερα sp σύνθετα (ή υβριδικά) τροχιακά.
- Ονομάζεται επίσης τετραεδρικός υβριδισμός.
- τα υβριδικά τροχιακά sp είναι ισοδύναμα και συμμετρικά υβριδικά τροχιακά.
- Έχουν το ίδιο σχήμα και την ίδια ενέργεια.
- Κάθε υβριδικό τροχιακό sp έχει ένα τέταρτο χαρακτήρα s και τρία τέταρτα χαρακτήρα p, δηλαδή 25% χαρακτήρα s και 75% χαρακτήρα p.
- Τα μόρια που σχηματίζονται είναι τετράεδρα στη γεωμετρία και επομένως έχουν γωνία δεσμού 109,5°. Ονομάζεται επίσης τετραεδρική γωνία.
- Παράδειγμα:H2 O, H,2 S, C2 H6 , SiCl4 , CH4 , κ.λπ.
- sp d υβριδισμός:
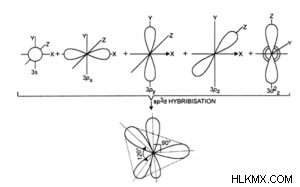
- Ένα s, τρία p και ένα d αναμιγνύονται τροχιακά και σχηματίζουν πέντε sp d αναμειγνύονται (ή υβριδικά) τροχιακά.
- Ονομάζεται επίσης τριγωνικός διπυραμιδικός υβριδισμός.
- Έχουν το ίδιο σχήμα και την ίδια ενέργεια.
- Τα μόρια που σχηματίζονται είναι τριγωνικά διπυραμιδικά στη γεωμετρία και επομένως έχουν γωνία δεσμού 120° στο οριζόντιο επίπεδο και 90° στο κατακόρυφο επίπεδο.
- Κατευθύνονται προς τις πέντε γωνίες μιας κανονικής πενταγωνικής διπυραμίδας, δηλαδή, η διάταξη των πέντε υβριδικών τροχιακών στο διάστημα είναι πενταγωνική διπυραμιδική.
- Παράδειγμα:PCl5 , SbF5 , ClF3 , XeF2 , κ.λπ.
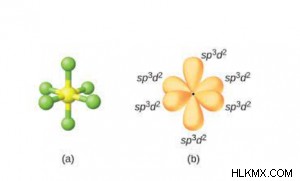
- sp d υβριδισμός:
- Ένα s, δύο d και τρία τροχιακά p αναμιγνύονται για να σχηματίσουν έξι sp δ υβριδικά τροχιακά.
- Έχουν το ίδιο σχήμα και την ίδια ενέργεια.
- Τα μόρια που σχηματίζονται είναι οκτάεδρα στη γεωμετρία και επομένως έχουν γωνία δεσμού 90°.
- Κατευθύνονται προς τις έξι γωνίες ενός κανονικού (συμμετρικού) οκταέδρου, δηλαδή την οκταεδρική διάταξη των έξι υβριδικών τροχιακών στο διάστημα.
- Παράδειγμα:SF6 , SeF6 , IF5 , XeF4 , κ.λπ.
-
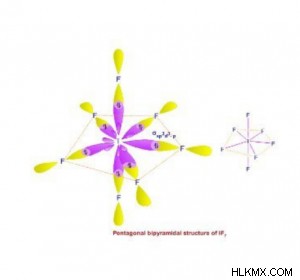
- sp d υβριδισμός:
- Ένα s, τρία p και τρία d τροχιακά αναμειγνύονται για να σχηματίσουν έξι sp δ υβριδικά τροχιακά.
- Έχουν το ίδιο σχήμα και την ίδια ενέργεια.
- Κατευθύνονται προς τις επτά γωνίες ενός κανονικού (συμμετρικού) πενταγωνικού διπυραμιδικού, δηλαδή η διάταξη επτά υβριδικών τροχιακών στο διάστημα είναι το πενταγωνικό διπυραμιδικό.
- Τα μόρια που σχηματίζονται είναι τριγωνικά διπυραμιδικά στη γεωμετρία και επομένως έχουν γωνία δεσμού 120° στο οριζόντιο επίπεδο και 90° στο κατακόρυφο επίπεδο.
- Το άθροισμα των ζευγών 𝜎-bond και των μοναχικών ζευγών στα είδη που εμφανίζουν sp δ Ο υβριδισμός είναι πάντα ίσος με 7.
- Παράδειγμα:IF7 , XeF6 , ReF7 , κ.λπ.
Οι διαφορετικοί τύποι υβριδισμών σε ένα γράφημα δίνονται παρακάτω:
| Τύπος μορίου | Αριθμός ζευγών ηλεκτρονίων | Γεωμετρία | Γωνία δεσμού | Υβριδισμός | Παράδειγμα |
| AB2 | 2 | Γραμμικό | 180° | sp | BeCl2 |
| AB3 | 3 | Τριγωνικό επίπεδο | 120° | sp | BF3 |
| AB4 | 4 | Τετραεδρικό | 109,5° | sp | CH4 |
| AB5 | 5 | Τριγωνικό διπυραμιδικό | 90°, 120° | spd | PCl5 |
| AB6 | 6 | Οκτάεδρος | 90° | spd | SF6 |
| AB2 E | 3 | Λυγισμένο | 120° (119°) | sp | SO2 |
| AB3 E | 4 | Τριγωνικό διπυραμιδικό | 109,5° (107,5°) | sp | NH3 |
| AB2 E2 | 4 | Λυγισμένο | 109,5° (104,5°) | sp | H2 O |
| AB4 E | 5 | See-saw | 180°, 120° (173,1°, 101,6°) | spd | SF4 |
| AB3 E2 | 5 | Σχήμα Τ | 90°, 180° (87,5°, <180°) | spd | ClF3 |
| AB2 E3 | 5 | Γραμμικό | 180° | spd | XeF2 |
| AB5 E | 6 | Τετράγωνο πυραμιδικό | 90° (84,8°) | spd | BrF5 |
| AB4 E2 | 6 | Τετράγωνο επίπεδο | 90° | spd | XeF4 |
| AB7 | 7 | Πεντάγωνο διπυραμιδικό | 90°, 180° | spd | XeF6 |
Ανάγκη υβριδισμού
Ας πάρουμε, για παράδειγμα, το BeCl2 μόριο για να κατανοήσουμε την ανάγκη για υβριδισμό.
Η διαμόρφωση βασικής κατάστασης του βηρυλλίου (Be) είναι 1s 2s.
Έτσι, για να σχηματίσει δύο δεσμούς, μπαίνει σε διεγερμένη κατάσταση,
Be- 1s 2s 2p
Σε αυτή την κατάσταση, το Be μπορεί να σχηματίσει δεσμούς με δύο Cl, αλλά οι δεσμοί δεν θα ήταν ίσοι (πανομοιότυποι). Είναι επειδή ένας δεσμός θα αποτελείται από το σφαιρικό τροχιακό 2s του Be που επικαλύπτεται με ένα τροχιακό 3p σε σχήμα κουδουνιού του Cl. Αντίθετα, ο άλλος δεσμός θα αποτελείται από το τροχιακό 2p σχήματος κουδουνιού του Be που επικαλύπτεται με το τροχιακό σχήματος κουδουνιού του Cl.
Αλλά το πραγματικό σχήμα του BeCl2 το μόριο είναι γραμμικό και ίσο. Σημαίνει ότι τα μήκη και οι ενέργειες των δεσμών και για τους δύο δεσμούς Be-Cl είναι πανομοιότυπες. Αυτή η αντίφαση επιλύθηκε με τη θεωρία του υβριδισμού. Ως εκ τούτου, εγείρει την ανάγκη για υβριδισμό σε μόρια.
Συμπέρασμα
Από την παραπάνω συζήτηση, είστε πλέον πολύ έμπειροι σε ερωτήσεις όπως τι είναι ο υβριδισμός, διαφορετικοί τύποι, διαγράμματα κ.λπ. Είναι ένας πολύ βολικός τρόπος να εξηγήσετε τους χημικούς δεσμούς μεταξύ διαφορετικών ατόμων.
Εν ολίγοις, είναι το φαινόμενο της ανάμειξης δύο ή περισσότερων εκφυλισμένων ατομικών τροχιακών για να σχηματιστεί ένα νέο σύνολο τροχιακών. Και για να θυμάστε διαφορετικούς τύπους υβριδισμών, και ένα γράφημα είναι ο καλύτερος δυνατός τρόπος.
Συχνές ερωτήσεις
Ε1. Ποια είναι τα κύρια χαρακτηριστικά του υβριδισμού;
Απάντηση: Τα κύρια χαρακτηριστικά του υβριδισμού είναι τα παρακάτω:
- Ο αριθμός των υβριδικών τροχιακών που σχηματίζονται ισούται με τον συνολικό αριθμό των καθαρών ατομικών τροχιακών που υβριδοποιούνται.
- Τα ατομικά τροχιακά μπορούν να αναμειχθούν αποτελεσματικά για να δώσουν υβριδικά τροχιακά μόνο όταν έχουν σχεδόν την ίδια ενέργεια και την ίδια συμμετρία.
- Τα υβριδικά τροχιακά είναι πιο επιτυχημένα στο σχηματισμό σταθερών δεσμών 𝜎 από τα καθαρά ατομικά τροχιακά (𝜋-δεσμός).
- Αυτά τα υβριδικά τροχιακά διέπονται στο διάστημα σε συγκεκριμένες κατευθύνσεις γύρω από το κεντρικό άτομο. Αυτή η διάταξη σταθεροποίησε τη γεωμετρία ελαχιστοποιώντας την απώθηση μεταξύ των ζευγών ηλεκτρονίων. Επομένως, ο τύπος υβριδισμού υποδεικνύει τον χωρικό προσανατολισμό των μορίων.
- Μόνο τα ζεύγη δεσμών 𝜎 και τα μόνα ζεύγη ηλεκτρονίων αποφασίζουν για το σχήμα του μορίου. Το 𝜋-bond δεν συμμετέχει σε αυτό.
Ε2. Ποιες είναι οι ζωτικές συνθήκες για τον υβριδισμό;
Απάντηση: Οι ζωτικές συνθήκες για τον υβριδισμό είναι:
- Τα τροχιακά που υπάρχουν στο κέλυφος σθένους του ατόμου είναι υβριδοποιημένα.
- Τα τροχιακά που συναντούν υβριδισμό θα πρέπει να έχουν σχεδόν ίση ενέργεια.
- Η προώθηση των ηλεκτρονίων δεν είναι απαραίτητη προϋπόθεση πριν από τον υβριδισμό.
- Μόνο τα μισογεμάτα τροχιακά δεν χρειάζεται να συμμετέχουν στον υβριδισμό. Σε ορισμένες περιπτώσεις, ακόμη και τροχιακά κελύφους γεμάτου σθένους συμμετέχουν σε αυτό.
Ε3. Ποιοι είναι οι παράγοντες που αποφασίζουν τον υβριδισμό ενός μορίου;
Απάντηση: Τρεις βασικοί παράγοντες αποφασίζουν τον υβριδισμό ενός μορίου. Αυτά είναι:
- Ο αριθμός των 𝜎-bonds: Οι δεσμοί παίζουν σημαντικό ρόλο στο σχηματισμό σχήματος ενός μορίου. Αυτοί οι δεσμοί είναι ισχυροί από τους δεσμούς 𝜋.
- Ο αριθμός των μοναχικών ζευγών: Τα μεμονωμένα ζεύγη αποφασίζουν τον χωρικό προσανατολισμό ενός μορίου. Για παράδειγμα, στην περίπτωση του H2 Ο, ο υβριδισμός είναι sp . Αλλά λόγω της απώθησης lp-lp, η γωνία δεσμού μειώθηκε από 109,5° σε 104,5°.
- 𝜋-οι δεσμοί προκύπτουν από μη υβριδικά τροχιακά.
Q4 Τι είναι ο Τροχιακός υβριδισμός;
Απάντηση: Σύμφωνα με τη θεωρία του δεσμού σθένους, ο τροχιακός υβριδισμός είναι η διαδικασία συνδυασμού ατομικών τροχιακών για τη δημιουργία νέων υβριδικών τροχιακών που είναι ιδανικά για τη σύζευξη ηλεκτρονίων για να σχηματίσουν χημικούς δεσμούς.




