Διαφορά μεταξύ ατομικότητας και σθένους
Κύρια διαφορά – Ατομικότητα έναντι σθένους
Η ατομικότητα και το σθένος είναι δύο χημικοί όροι που χρησιμοποιούνται συχνά για άτομα και μόρια. Ατομικότητα είναι ο αριθμός των ατόμων που υπάρχουν σε ένα μόριο. Το σθένος είναι ο μέγιστος αριθμός ηλεκτρονίων που πρέπει να χάσει, να κερδίσει ή να μοιραστεί ένα άτομο για να σταθεροποιηθεί. Επομένως, αυτές είναι δύο διακριτές ιδιότητες των ατόμων και των μορίων. Η κύρια διαφορά μεταξύ ατομικότητας και σθένους είναι ότι η ατομικότητα εξηγεί μια μοριακή ιδιότητα ενώ το σθένος περιγράφει μια στοιχειακή ιδιότητα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Atomicity
– Ορισμός, τύποι με παραδείγματα
2. Τι είναι το Valency
– Ορισμός, Εξήγηση με Παράδειγμα
3. Ποια είναι η διαφορά μεταξύ ατομικότητας και σθένους
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομικότητα, Διατομική, Διαμόρφωση ηλεκτρονίων, Αδρανή αέρια, Μονοατομική, Πολυατομική, Θείο, Σθένος

Τι είναι η Atomicity
Ατομικότητα είναι ο συνολικός αριθμός ατόμων που υπάρχουν σε ένα μόριο. Σύμφωνα με αυτόν τον ορισμό, τα μόρια μπορούν να χωριστούν σε ομάδες ανάλογα με την ατομικότητα των μορίων. Για παράδειγμα, τα μόρια μπορεί να είναι μονοατομικά, διατομικά, τριατομικά ή πολυατομικά. Οι μονοατομικές ενώσεις αποτελούνται από ένα μόνο άτομο. Για παράδειγμα, αδρανή αέρια όπως το ήλιο (He), το αργό (Ar) κ.λπ. είναι μονοατομικές ενώσεις. Οι διατομικές ενώσεις αποτελούνται από δύο άτομα ανά μόριο. Π.χ.:αέριο οξυγόνο (O2 ), αέριο άζωτο (N2 ), αέριο χλώριο (Cl2 ), κ.λπ.
Το σύμβολο για την ατομικότητα είναι "a". Άρα για τις μονοατομικές ενώσεις a=1 και για τις διατομικές ενώσεις a=2. Για πολυατομικές ενώσεις, η ατομικότητα είναι μεγάλη τιμή. Αυτό γιατί τα πολυατομικά μόρια αποτελούνται από μεγάλο αριθμό ατόμων.
Εικόνα 1:Ένα πολυατομικό μόριο
Όταν ληφθεί υπόψη η ατομικότητα των ενώσεων που σχηματίζονται από τα στοιχεία της ίδιας ομάδας (στον περιοδικό πίνακα), μπορούμε να παρατηρήσουμε σχέσεις στις χημικές και φυσικές ιδιότητες αυτών των ενώσεων. Για παράδειγμα, όλα τα αδρανή αέρια είναι μονοατομικές ενώσεις που έχουν παρόμοιες χημικές ιδιότητες. Αν και ορισμένες ενώσεις είναι πολύ διαφορετικές μεταξύ τους ως προς τις χημικές και φυσικές τους ιδιότητες, μπορεί να ανήκουν στην ίδια ομάδα ενώσεων ανάλογα με την ατομικότητα αυτών των ενώσεων. Για παράδειγμα, Cl2 είναι μια αέρια ένωση ενώ το I2 είναι στερεό σε θερμοκρασία δωματίου. Αλλά και οι δύο αυτές ενώσεις είναι διατομικές ενώσεις όταν ληφθούν υπόψη οι τιμές ατομικότητάς τους.
Τι είναι το Valency
Το σθένος μπορεί να οριστεί ως ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χάσει, να αποκτήσει ή να μοιραστεί ένα άτομο προκειμένου να σταθεροποιηθεί. Για μέταλλα και αμέταλλα, ο κανόνας της οκτάδας περιγράφει την πιο σταθερή μορφή ενός ατόμου. Λέει ότι αν ο αριθμός του εξωτερικού φλοιού ενός ατόμου είναι πλήρως γεμάτος με οκτώ ηλεκτρόνια, αυτή η διαμόρφωση είναι σταθερή. Με άλλα λόγια, εάν τα υπο-τροχιακά s και p είναι πλήρως γεμάτα, έχοντας nsnp, είναι σταθερό. Φυσικά, τα άτομα ευγενών αερίων έχουν αυτή τη διαμόρφωση ηλεκτρονίων. Επομένως, άλλα στοιχεία πρέπει είτε να χάσουν, είτε να κερδίσουν ή να μοιραστούν ηλεκτρόνια για να υπακούσουν στον κανόνα της οκτάδας. Ο μέγιστος αριθμός ηλεκτρονίων που εμπλέκονται σε αυτή τη διαδικασία σταθεροποίησης ονομάζεται σθένος αυτού του ατόμου.
Ας εξετάσουμε το θείο ως παράδειγμα. Το σθένος του θείου μπορεί να προσδιοριστεί όπως παρακάτω.
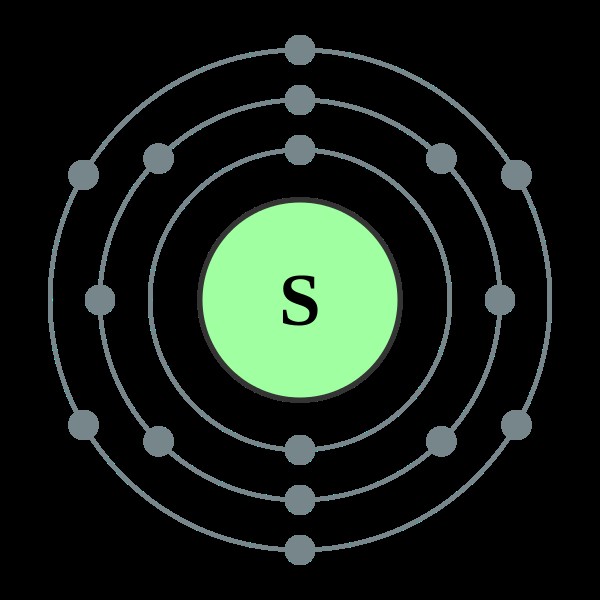
Εικόνα 2:Χημική δομή του ατόμου θείου
Ο αριθμός των ηλεκτρονίων στο εξώτατο τροχιακό του θείου είναι 6. Για να σταθεροποιηθεί, ο αριθμός των ηλεκτρονίων στο εξώτατο τροχιακό θα πρέπει να είναι 8 (σύμφωνα με τον κανόνα της οκτάδας). Στη συνέχεια, το θείο πρέπει να αποκτήσει ή να μοιραστεί 2 ακόμη ηλεκτρόνια από το εξωτερικό. Επομένως, το σθένος του θείου είναι 2.
Ωστόσο, τα στοιχεία μετάβασης μπορεί να έχουν διαφορετικά σθένη. Αυτό συμβαίνει επειδή τα μέταλλα μετάπτωσης μπορούν να σταθεροποιηθούν αφαιρώντας διαφορετικούς αριθμούς ηλεκτρονίων.
Διαφορά μεταξύ Ατομικότητας και Σθένους
Ορισμός
Ατομικότητα: Ατομικότητα είναι ο συνολικός αριθμός ατόμων που υπάρχουν σε ένα μόριο.
Σθένος: Το σθένος είναι ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χάσει, να αποκτήσει ή να μοιραστεί ένα άτομο προκειμένου να σταθεροποιηθεί.
Προσδιορισμός
Ατομικότητα: Η ατομικότητα μπορεί να προσδιοριστεί με τον υπολογισμό του αριθμού των ατόμων που υπάρχουν ανά μόριο μιας ουσίας.
Σθένος: Το σθένος μπορεί να προσδιοριστεί εξετάζοντας τη διαμόρφωση ηλεκτρονίων ενός ατόμου.
Αριθμός ατόμων
Ατομικότητα: Η ατομικότητα εξαρτάται από τον αριθμό των ατόμων που υπάρχουν σε ένα μόριο.
Σθένος: Το σθένος δεν εξαρτάται από τον αριθμό των ατόμων.
Σχέση με το ηλεκτρόνιο
Ατομικότητα: Η ατομικότητα δεν έχει σχέση με τον αριθμό των ηλεκτρονίων σε ένα άτομο.
Σθένος: Το σθένος έχει άμεση σχέση με τον αριθμό των ηλεκτρονίων.
Διαφορετικοί τύποι
Ατομικότητα: Οι ενώσεις μπορούν να χωριστούν σε διάφορες ομάδες ανάλογα με την ατομικότητα ως μονοατομικές, διατομικές, τριατομικές και πολυατομικές ενώσεις.
Σθένος: Τα στοιχεία μπορούν να ονομαστούν ως μονοσθενή στοιχεία, στοιχεία δισθενούς κ.λπ. ανάλογα με το σθένος του στοιχείου.
Συμπέρασμα
Ατομικότητα είναι ο αριθμός των ατόμων που υπάρχουν σε ένα μόριο. Το σθένος είναι ο μέγιστος αριθμός ηλεκτρονίων που πρέπει να χάσει, να κερδίσει ή να μοιραστεί ένα άτομο για να σταθεροποιηθεί. Η κύρια διαφορά μεταξύ ατομικότητας και σθένους είναι ότι η ατομικότητα εξηγεί μια μοριακή ιδιότητα ενώ το σθένος περιγράφει μια στοιχειακή ιδιότητα.




