Διαφορά μεταξύ υδρογόνωσης και αναγωγής
Κύρια διαφορά – Υδρογόνωση vs Αναγωγή
Οι αντιδράσεις υδρογόνωσης και αναγωγής είναι σχετικές χημικές διεργασίες. Η υδρογόνωση είναι ένας τύπος αναγωγής. Η αναγωγή έχει τρεις διαφορετικούς ορισμούς:μείωση του αριθμού οξείδωσης, απώλεια οξυγόνου και πρόσληψη υδρογόνου. Ο πιο αποδεκτός ορισμός είναι η μείωση του αριθμού οξείδωσης. Ο τρίτος ορισμός (απόκτηση υδρογόνου) ταιριάζει με τον ορισμό της υδρογόνωσης. Ωστόσο, ηυδρογόνωση απαιτεί ουσιαστικά καταλύτη ενώ η αναγωγή δεν απαιτεί καταλύτη, εκτός εάν πρόκειται για υδρογόνωση. Αυτή είναι η κύρια διαφορά μεταξύ υδρογόνωσης και αναγωγής.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Υδρογόνωση
– Ορισμός, Μηχανισμός
2. Τι είναι η Μείωση
– Ορισμός, Επεξήγηση, Παραδείγματα
3. Ποια είναι η σχέση Υδρογόνωσης και Αναγωγής
4. Ποια είναι η διαφορά μεταξύ υδρογόνωσης και αναγωγής
– Σύγκριση βασικών διαφορών
Βασικοί όροι:καταλύτης, υδρογόνωση, νικέλιο, οξείδωση, αριθμός οξείδωσης, παλλάδιο, λευκόχρυσος, αντιδράσεις οξειδοαναγωγής, αναγωγή, κορεσμός, ακόρεστα

Τι είναι η υδρογόνωση
Η υδρογόνωση είναι μια χημική αντίδραση μεταξύ μοριακού υδρογόνου (H2 ) και ένα άλλο χημικό είδος. Μια υδρογόνωση λαμβάνει χώρα συνήθως παρουσία ενός καταλύτη όπως το νικέλιο, το παλλάδιο ή η πλατίνα και τα οξείδια τους. Η υδρογόνωση χρησιμοποιείται για την αναγωγή και τον κορεσμό μιας χημικής ένωσης. Μπορεί να υπάρχουν δύο τύποι υδρογόνωσης:
- Προσθήκη υδρογόνου σε διπλό ή τριπλό δεσμό σε ένωση
- Προσθήκη υδρογόνου που προκαλεί διάσταση του μορίου
Σχεδόν όλες οι οργανικές ενώσεις που αποτελούνται από διπλούς δεσμούς ή τριπλούς δεσμούς μπορούν να αντιδράσουν με μοριακό υδρογόνο παρουσία καταλύτη. Η αντίδραση υδρογόνωσης έχει μεγάλη σημασία για τις διαδικασίες βιομηχανικής σύνθεσης. για παράδειγμα, στη βιομηχανία πετρελαίου, η υδρογόνωση χρησιμοποιείται για την παραγωγή βενζίνης και διαφόρων πετροχημικών.
Μηχανισμός Υδρογόνωσης
Κατά την εξέταση του μηχανισμού της υδρογόνωσης, υπάρχουν τρία κύρια στοιχεία που πρέπει να ληφθούν υπόψη. Είναι το ακόρεστο υπόστρωμα, η πηγή υδρογόνου και ο καταλύτης. Η θερμοκρασία και η πίεση του συστήματος μπορεί να διαφέρουν ανάλογα με το υπόστρωμα και τον καταλύτη που χρησιμοποιείται.
Η πηγή υδρογόνου είναι συχνά το ίδιο το αέριο υδρογόνο. Διατίθεται στο εμπόριο σε κυλίνδρους υπό πίεση. Τα υποστρώματα για την υδρογόνωση μπορεί να είναι αλκένια, αλκίνια, αλδεΰδες, αλκοόλες, κετόνες, εστέρες, καρβοξυλικά οξέα και νιτροενώσεις. Οι καταλύτες βρίσκονται σε δύο τύπους ως ομογενείς καταλύτες και ετερογενείς καταλύτες. Η διαφορά μεταξύ ομογενών και ετερογενών καταλυτών είναι ότι οι ομογενείς καταλύτες διαλύονται στο διάλυμα που περιέχει το υπόστρωμα, ενώ οι ετερογενείς καταλύτες αιωρούνται σε αυτό το διάλυμα.

Εικόνα 1:Μηχανισμός Υδρογόνωσης
Η υδρογόνωση που συμβαίνει στα στερεά (ετερογενής καταλύτης) εξηγείται από τον μηχανισμό Horiuti-Polanyi. Αναφέρει τα ακόλουθα βήματα.
- Σύνδεση του ακόρεστου δεσμού και του ατομικού υδρογόνου (από τη διάσταση του μοριακού υδρογόνου) στην επιφάνεια του καταλύτη.
- Προσθήκη ενός ατόμου υδρογόνου στον ακόρεστο δεσμό. Αυτό το βήμα είναι αναστρέψιμο.
- Προσθήκη δεύτερου ατόμου υδρογόνου. αυτό είναι μη αναστρέψιμο.
Όμως σε διαδικασίες υδρογόνωσης που περιλαμβάνουν ομοιογενή κατάλυση, το μέταλλο συνδέεται και με τα δύο συστατικά για να δώσει ένα ενδιάμεσο αλκένιο-μέταλλο(H)2 σύνθετο.
Τι είναι η Μείωση
Η μείωση είναι η μείωση του αριθμού οξείδωσης ενός χημικού είδους. Συνήθως γίνεται με προσθήκη ηλεκτρονίων. Μια αντίδραση αναγωγής είναι μια μισή αντίδραση που συμβαίνει παράλληλα με μια αντίδραση οξείδωσης σε αντιδράσεις οξειδοαναγωγής. Η αντίδραση οξείδωσης αυξάνει τον αριθμό οξείδωσης. Επομένως, η αναγωγή είναι το αντίθετο της οξείδωσης.
Όμως σε ορισμένες αντιδράσεις, η οξείδωση και η αναγωγή αναφέρονται στην προσθήκη ή αφαίρεση οξυγόνου αντίστοιχα. Εδώ, η οξείδωση είναι το κέρδος οξυγόνου ενώ η μείωση είναι η απώλεια οξυγόνου. Ένας άλλος παλαιότερος ορισμός για την οξείδωση και την αναγωγή περιλαμβάνει τη μεταφορά υδρογόνου. Εδώ, η οξείδωση είναι η απώλεια υδρογόνου ενώ η αναγωγή είναι το κέρδος του υδρογόνου. Ωστόσο, σύμφωνα με τους γενικά αποδεκτούς ορισμούς, η οξείδωση είναι γνωστό ότι είναι η αύξηση της κατάστασης οξείδωσης ενώ η αναγωγή είναι γνωστή ως η μείωση της κατάστασης οξείδωσης.
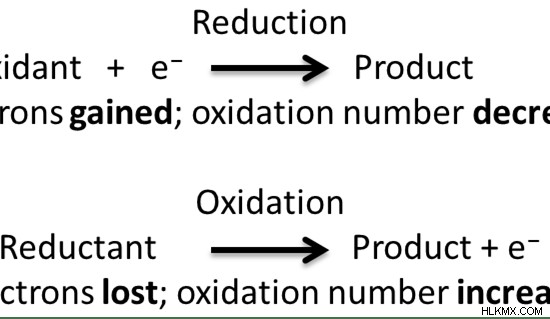
Εικόνα 2:Αντιδράσεις οξειδοαναγωγής
Η μείωση μπορεί να είναι ένα από τα τρία παρακάτω φαινόμενα.
- Μείωση του αριθμού οξείδωσης από θετική τιμή σε αρνητική τιμή
- Μείωση του αριθμού οξείδωσης από θετική τιμή σε μηδέν
- Μείωση του αριθμού οξείδωσης από μηδέν σε αρνητική τιμή.
Παραδείγματα
Μερικά κοινά παραδείγματα αντιδράσεων αναγωγής:
- Μείωση του σιδήρου (III) σε σίδηρο (II):
- Μείωση του H σε H2
- Μείωση του Cu σε Cu
Σχέση μεταξύ υδρογόνωσης και μείωσης
- Η υδρογόνωση είναι ένας τύπος αντίδρασης αναγωγής. Ένας από τους τρεις ορισμούς της αναγωγής υποδηλώνει ότι η αύξηση του υδρογόνου είναι μείωση.
Διαφορά μεταξύ υδρογόνωσης και μείωσης
Ορισμός
Υδρογόνωση: Η υδρογόνωση είναι μια χημική αντίδραση μεταξύ μοριακού υδρογόνου (H2 ) και ένα άλλο χημικό είδος.
Μείωση: Η μείωση είναι η μείωση του αριθμού οξείδωσης ενός χημικού είδους.
Μηχανισμός
Υδρογόνωση: Η υδρογόνωση είναι ουσιαστικά η προσθήκη υδρογόνου.
Μείωση: Η μείωση είναι η μείωση του αριθμού οξείδωσης. απώλεια οξυγόνου? πρόσληψη υδρογόνου.
Στοιχεία
Υδρογόνωση: Οι ενώσεις που περιέχουν διπλούς δεσμούς ή τριπλούς δεσμούς θα υποστούν υδρογόνωση.
Μείωση: Χημικά είδη που έχουν υψηλότερο αριθμό οξείδωσης μπορούν να υποστούν αναγωγή.
Καταλύτης
Υδρογόνωση: Η υδρογόνωση απαιτεί έναν καταλύτη ως βασικό συστατικό.
Μείωση: Η αντίδραση αναγωγής δεν απαιτεί καταλύτη εκτός εάν πρόκειται για υδρογόνωση.
Συμπέρασμα
Η υδρογόνωση είναι ένας τύπος αντίδρασης αναγωγής. Χρησιμοποιείται για τη μετατροπή ακόρεστων ενώσεων σε κορεσμένες ενώσεις. Η μείωση αναφέρεται στη μείωση του αριθμού οξείδωσης ενός χημικού είδους. Συμβαίνει πάντα παράλληλα με μια αντίδραση οξείδωσης. Η κύρια διαφορά μεταξύ υδρογόνωσης και αναγωγής είναι ότι η υδρογόνωση απαιτεί ουσιαστικά καταλύτη, ενώ η αναγωγή δεν απαιτεί καταλύτη εκτός εάν πρόκειται για υδρογόνωση.
Αναφορά:
1. Helmenstine, Anne Marie. «Ο ορισμός της αναγωγής στη χημεία». ThoughtCo, 3 Σεπτεμβρίου 2017, Διαθέσιμο εδώ.
2. Libretexts. «Ορισμοί της οξείδωσης και της αναγωγής». Chemistry LibreTexts, Libretexts, 2 Μαΐου 2016, Διαθέσιμο εδώ.
3. "Υδρογόνωση." Encyclopædia Britannica, Encyclopædia Britannica, inc., 1 Μαΐου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Μηχανισμός που περιλαμβάνει υδρογόνωση παλλαδίου» του Wesleye1000 – Δική του εργασία (CC BY-SA 4.0) μέσω Commons Wikimedia
2. "Redox Halves" By Cameron Garnham – Δικό έργο (CC BY-SA 3.0) μέσω Commons Wikimedia




