Διαφορά μεταξύ Bohr και Quantum Model
Κύρια διαφορά – Bohr vs Quantum Model
Διάφοροι επιστήμονες πρότειναν διαφορετικά μοντέλα για να εξηγήσουν τη δομή ενός ατόμου. Τα μοντέλα Bohr και κβαντικά είναι δύο τέτοια μοντέλα. Το μοντέλο Bohr είναι ένα προηγμένο μοντέλο, αλλά απέτυχε να εξηγήσει ορισμένα αποτελέσματα όπως το φαινόμενο Zeeman και το φαινόμενο Stark που παρατηρήθηκαν σε φάσματα γραμμής μεγάλων ατόμων. Το κβαντικό μοντέλο θεωρείται ως το σύγχρονο μοντέλο για την περιγραφή της δομής ενός ατόμου. Η κύρια διαφορά μεταξύ του μοντέλου Bohr και του Κβαντικού μοντέλου είναι ότι Το μοντέλο Bohr εξηγεί τη συμπεριφορά των σωματιδίων ενός ηλεκτρονίου ενώ το κβαντικό μοντέλο εξηγεί τη δυαδικότητα κύματος-σωματιδίου ενός ηλεκτρονίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Bohr Model
– Ορισμός, Έννοια, Μειονεκτήματα
2. Τι είναι το Κβαντικό Μοντέλο
– Ορισμός, Έννοια
3. Ποια είναι η διαφορά μεταξύ του Bohr και του Κβαντικού Μοντέλου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Μοντέλο Bohr, Electron, Electron Shells, Quantum Model, Quantum Numbers, Rutherford Model, Stark Effect, Zeeman Effect

Τι είναι το μοντέλο Bohr
Το μοντέλο του Bohr είναι ένα ατομικό μοντέλο που προτάθηκε από τον Niels Bohr (το 1915) για να εξηγήσει τη δομή ενός ατόμου. Θεωρείται ως τροποποίηση του μοντέλου Rutherford. Αυτό το μοντέλο είναι πιο προηγμένο από το μοντέλο Rutherford, το οποίο δεν περιγράφει την κίνηση των ηλεκτρονίων κατά μήκος των φλοιών ηλεκτρονίων γύρω από τον πυρήνα. Το μοντέλο Bohr εξηγεί επίσης ότι αυτά τα κελύφη ηλεκτρονίων βρίσκονται σε διακριτά ενεργειακά επίπεδα.
Το μοντέλο Bohr αναπτύχθηκε με παρατηρήσεις των γραμμικών φασμάτων του ατόμου του υδρογόνου. Λόγω της παρουσίας διακριτών γραμμών στα φάσματα γραμμής, ο Bohr δήλωσε ότι τα τροχιακά ενός ατόμου έχουν σταθερές ενέργειες και τα ηλεκτρόνια μπορούν να μεταπηδήσουν από το ένα επίπεδο ενέργειας στο άλλο ενώ εκπέμπουν ή απορροφούν ενέργεια, με αποτέλεσμα μια γραμμή στα φάσματα γραμμής. /P>
Έννοιες στο μοντέλο Bohr
- Τα ηλεκτρόνια κινούνται γύρω από τον πυρήνα σε σφαιρικά τροχιακά που έχουν σταθερό μέγεθος και ενέργεια.
- Η ενέργεια ενός τροχιακού σχετίζεται με το μέγεθός του.
- Η μικρότερη τροχιά έχει τη χαμηλότερη ενέργεια.
- Το άτομο είναι εντελώς σταθερό όταν τα ηλεκτρόνια βρίσκονται στο χαμηλότερο ενεργειακό επίπεδο.
- Τα ηλεκτρόνια μπορούν να μετακινηθούν από το ένα επίπεδο ενέργειας στο άλλο απορροφώντας ή απελευθερώνοντας ενέργεια με τη μορφή ακτινοβολίας.
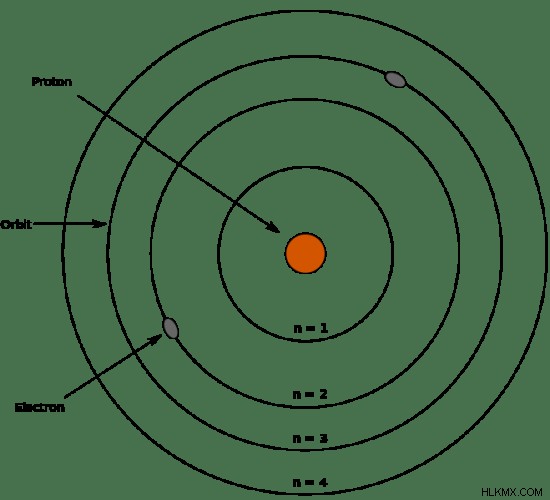
Εικόνα 1:Μοντέλο Bohr
Το μοντέλο Bohr ταιριάζει απόλυτα στο άτομο υδρογόνου, το οποίο έχει ένα μόνο ηλεκτρόνιο και έναν μικρό θετικά φορτισμένο πυρήνα. Υπάρχουν όμως λίγα μειονεκτήματα του μοντέλου Bohr όταν εξηγεί την ατομική δομή ατόμων εκτός του Υδρογόνου. Το μοντέλο Bohr δεν μπορούσε να εξηγήσει το φαινόμενο Zeeman (επίδραση του μαγνητικού πεδίου στο ατομικό φάσμα) ή το έντονο αποτέλεσμα (επίδραση ηλεκτρικού πεδίου στο ατομικό φάσμα). Αυτό το μοντέλο δεν μπορεί επίσης να εξηγήσει τα φάσματα γραμμής μεγάλων ατόμων.
Τι είναι το Κβαντικό Μοντέλο
Το κβαντικό μοντέλο είναι ένα ατομικό μοντέλο που θεωρείται ως το σύγχρονο ατομικό μοντέλο για να εξηγήσει με ακρίβεια τη δομή ενός ατόμου. Μπορεί να περιγράψει τα αποτελέσματα που δεν μπορούσαν να εξηγηθούν από το μοντέλο Bohr.
Το κβαντικό μοντέλο εξηγεί τη δυαδικότητα κύματος-σωματιδίου ενός ηλεκτρονίου. Αν και το κβαντικό μοντέλο είναι πολύ πιο δύσκολο να κατανοηθεί από το μοντέλο του Bohr, εξηγεί με ακρίβεια τις παρατηρήσεις σχετικά με μεγάλα ή πολύπλοκα άτομα. Αυτό το κβαντικό μοντέλο βασίζεται στην κβαντική θεωρία. Σύμφωνα με την κβαντική θεωρία, ένα ηλεκτρόνιο έχει δυαδικότητα σωματιδίου-κύματος και είναι αδύνατο να εντοπιστεί η ακριβής θέση του ηλεκτρονίου (αρχή της αβεβαιότητας).
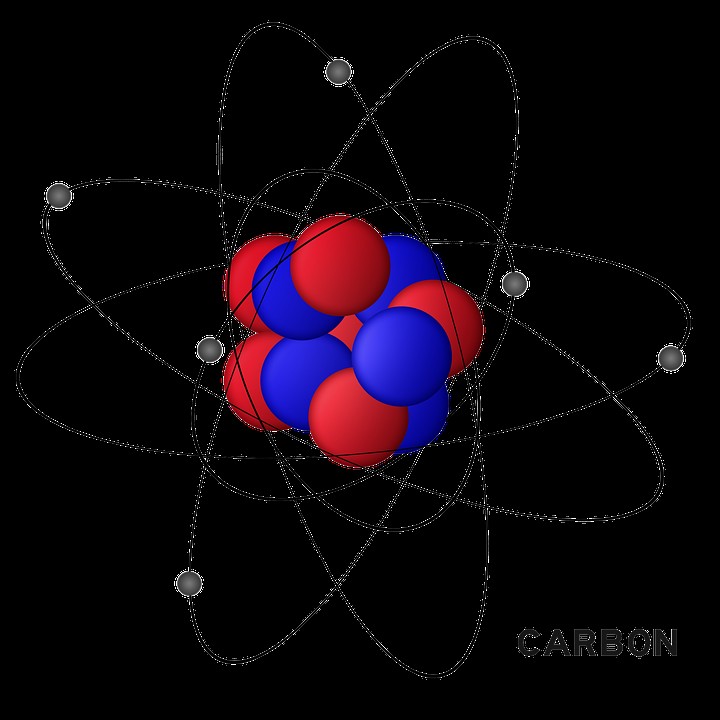
Εικόνα 2:Χωρική Δομή Ατομικών Τροχιακών
Δηλώνει επίσης ότι τα τροχιακά δεν είναι πάντα σφαιρικά. Τα τροχιακά έχουν συγκεκριμένα σχήματα για διαφορετικά επίπεδα ενέργειας και είναι τρισδιάστατες δομές. Σύμφωνα με το κβαντικό μοντέλο, ένα ηλεκτρόνιο μπορεί να ονομαστεί με τη χρήση κβαντικών αριθμών. Τέσσερις τύποι κβαντικών αριθμών χρησιμοποιούνται σε αυτό:
- Κβαντικός αριθμός αρχής, n (αυτό περιγράφει τη μέση απόσταση του τροχιακού από τον πυρήνα και το επίπεδο ενέργειας.)
- Κβαντικός αριθμός γωνιακής ορμής, I (αυτό περιγράφει το σχήμα του τροχιακού.)
- Μαγνητικός κβαντικός αριθμός, ml (αυτό περιγράφει τον προσανατολισμό των τροχιακών στο χώρο.)
- Κβαντικός αριθμός περιστροφής, ms (αυτό περιγράφει την περιστροφή ενός ηλεκτρονίου σε ένα μαγνητικό πεδίο και τα κυματικά χαρακτηριστικά του ηλεκτρονίου.
Διαφορά μεταξύ Bohr και Quantum Model
Ορισμός
Μοντέλο Bohr: Το μοντέλο του Bohr είναι ένα ατομικό μοντέλο που προτάθηκε από τον Niels Bohr (το 1915) για να εξηγήσει τη δομή ενός ατόμου.
Κβαντικό μοντέλο :Το κβαντικό μοντέλο είναι ένα ατομικό μοντέλο που θεωρείται ως το σύγχρονο ατομικό μοντέλο για να εξηγήσει με ακρίβεια τη δομή ενός ατόμου.
Έννοια
Μοντέλο Bohr: Το μοντέλο Bohr περιγράφει τη συμπεριφορά των σωματιδίων ενός ηλεκτρονίου.
Κβαντικό μοντέλο :Το κβαντικό μοντέλο περιγράφει τη δυαδικότητα κύματος-σωματιδίου ενός ηλεκτρονίου.
Κβαντικοί αριθμοί
Μοντέλο Bohr: Το μοντέλο Bohr δεν παρέχει πληροφορίες για κβαντικούς αριθμούς.
Κβαντικό μοντέλο :Το κβαντικό μοντέλο εξηγεί τους κβαντικούς αριθμούς.
Άλλα εφέ
Μοντέλο Bohr: Το μοντέλο Bohr δεν μπορεί να εξηγήσει το φαινόμενο Zeeman και το φαινόμενο Stark σε φάσματα γραμμής.
Κβαντικό μοντέλο :Το κβαντικό μοντέλο εξηγεί το φαινόμενο Zeeman και το φαινόμενο Stark.
Συμπέρασμα
Το μοντέλο Bohr και το κβαντικό μοντέλο είναι δύο μοντέλα στη χημεία που χρησιμοποιούνται για να εξηγήσουν τη δομή ενός ατόμου. Το μοντέλο Bohr παρουσιάζει ορισμένα μειονεκτήματα που εξηγούνται από το κβαντικό μοντέλο. Ως εκ τούτου, το κβαντικό μοντέλο θεωρείται ως το σύγχρονο μοντέλο για την ατομική δομή. Αυτή είναι η διαφορά μεταξύ του Bohr και του κβαντικού μοντέλου.