Διαφορά μεταξύ οξειδίων μετάλλων και οξειδίων μη μετάλλων
Κύρια διαφορά – Οξείδια μετάλλων έναντι οξειδίων μη μετάλλων
Οξείδιο είναι κάθε χημική ένωση που περιέχει ένα ή περισσότερα άτομα οξυγόνου. Τα μέταλλα είναι ουσίες που έχουν μοναδικές ιδιότητες, όπως εξαιρετική ηλεκτρική και θερμική αγωγιμότητα, ανακλαστικότητα του φωτός, ελατότητα και ολκιμότητα. Τα μέταλλα σχηματίζουν μια μεγάλη ποικιλία ενώσεων όπως αλογονίδια μετάλλων, οξείδια μετάλλων, θειούχα μετάλλων κ.λπ. Τα αμέταλλα είναι χημικά στοιχεία που δεν παρουσιάζουν μεταλλικές ιδιότητες. Τα περισσότερα μέλη του μπλοκ p στον περιοδικό πίνακα είναι αμέταλλα. Όταν εξετάζουμε τα οξείδια των στοιχείων, υπάρχουν οξείδια μετάλλων καθώς και μη μεταλλικά οξείδια. Τα οξείδια μετάλλων είναι οξείδια μετάλλων. Τα μη μεταλλικά οξείδια είναι οξείδια αμέταλλων. Η κύρια διαφορά μεταξύ οξειδίων μετάλλων και οξειδίων μη μετάλλων είναι ότι τα οξείδια μετάλλων είναι βασικές ενώσεις ενώ τα μη μεταλλικά οξείδια είναι όξινες ενώσεις.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα οξείδια μετάλλων
– Ορισμός, Ιδιότητες, Διαφορετικοί τύποι
2. Τι είναι τα μη μεταλλικά οξείδια
– Ορισμός, Ιδιότητες, Διαφορετικοί τύποι
3. Ποια είναι η διαφορά μεταξύ οξειδίων μετάλλων και οξειδίων μη μετάλλων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, βάση, μέταλλο, οξείδιο μετάλλου, μη μέταλλο, οξείδιο μη μετάλλου, οξυοξέα, οξείδιο, υπεροξείδιο, υπεροξείδιο

Τι είναι τα οξείδια μετάλλων
Τα οξείδια μετάλλων είναι χημικές ενώσεις που περιέχουν ένα μέταλλο και ένα ή περισσότερα άτομα οξυγόνου. Εδώ, ο αριθμός οξείδωσης του οξυγόνου είναι -2, και είναι ουσιαστικά το ανιόν όπου το μέταλλο είναι το κατιόν. Τα αλκαλικά μέταλλα (στοιχεία της ομάδας 1), τα μέταλλα των αλκαλικών γαιών (στοιχεία της ομάδας 2) και τα μέταλλα μεταπτώσεως (μερικά στοιχεία d μπλοκ) σχηματίζουν ιοντικά οξείδια. Αλλά τα μέταλλα που παρουσιάζουν υψηλές καταστάσεις οξείδωσης μπορούν να προέρχονται από οξείδια με ομοιοπολική φύση.
Τα οξείδια μετάλλων είναι κρυσταλλικές στερεές ενώσεις. Αυτές οι ενώσεις περιέχουν ένα κατιόν μετάλλου και ένα ανιόν οξειδίου. Αυτές οι ενώσεις είναι συχνά βασικές ενώσεις και μπορούν να αντιδράσουν με το νερό δίνοντας μια βάση. Εάν όχι, μπορούν να αντιδράσουν με οξέα σχηματίζοντας ένα άλας του μετάλλου.
Υπάρχουν τρεις τύποι οξειδίων μετάλλων που σχηματίζονται από αλκαλικά μέταλλα και μέταλλα αλκαλικών γαιών.
- Οξείδια που περιέχουν ανιόντα οξειδίου (O)
- Υπεροξείδια που περιέχουν ανιόντα υπεροξειδίου (O)
- Υπεροξείδια που περιέχουν ανιόντα υπεροξειδίου. (O2 )
Ο αριθμός των ατόμων οξυγόνου που συνδέονται με το μεταλλικό ιόν εξαρτάται από τον αριθμό οξείδωσης του μεταλλικού ιόντος. Τα αλκαλικά μέταλλα σχηματίζουν μόνο μονοσθενή κατιόντα. Επομένως, σχηματίζουν μόνο M2 Οξείδια τύπου O (όπου M είναι το ιόν μετάλλου και O είναι ανιόν οξειδίου). Τα μέταλλα των αλκαλικών γαιών σχηματίζουν δισθενή κατιόντα. Επομένως, σχηματίζουν κατιόντα τύπου MO.

Εικόνα 1:Οξείδια σπάνιων γαιών – Δεξιόστροφα από το επάνω κέντρο:Οξείδια πρασεοδύμιου, δημήτριου, λανθανίου, νεοδυμίου, σαμαρίου και γαδολινίου
Τόσο τα οξείδια των μετάλλων των αλκαλίων όσο και των μετάλλων των αλκαλικών γαιών σχηματίζουν υδροξείδια όταν αντιδρούν με το νερό. Επομένως, είναι βασικές ενώσεις. Τα στοιχεία του μπλοκ D σχηματίζουν διαφορετικά οξείδια ανάλογα με την κατάσταση οξείδωσης. Για παράδειγμα, το βανάδιο εμφανίζει καταστάσεις οξείδωσης +2, +3, +4 και +5. Ως εκ τούτου, τα οξείδια που μπορεί να σχηματίσει είναι VO, V2 O, VO2 και V2 O5 .
Τι είναι τα μη μεταλλικά οξείδια
Τα μη μεταλλικά οξείδια είναι ενώσεις οξειδίων που σχηματίζονται από μη μεταλλικά στοιχεία. Τα περισσότερα στοιχεία του μπλοκ p είναι αμέταλλα. Σχηματίζουν διάφορες ενώσεις οξειδίων. Τα μη μεταλλικά οξείδια είναι ομοιοπολικές ενώσεις, καθώς μοιράζονται ηλεκτρόνια με άτομα οξυγόνου για να σχηματίσουν μόρια οξειδίου.
Τα περισσότερα οξείδια μη μετάλλων δίνουν οξέα μετά την αντίδραση με το νερό. Επομένως, τα μη μεταλλικά οξείδια είναι όξινες ενώσεις. Για παράδειγμα, όταν SO3 διαλύεται στο νερό, δίνει H2 SO4 διάλυμα, το οποίο είναι πολύ όξινο. Τα μη μεταλλικά οξείδια αντιδρούν με βάσεις σχηματίζοντας άλατα.
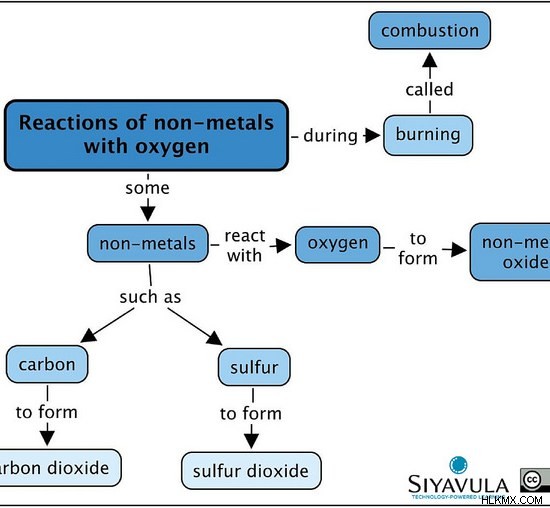
Σχήμα 2:Μερικές αντιδράσεις μη μετάλλων με οξυγόνο
Τα μη μεταλλικά οξείδια μπορούν να σχηματίσουν οξυοξέα . Τα οξυοξέα παράγουν ιόντα υδρονίου σε υδατικά διαλύματα. Υπάρχουν δύο τύποι όξινων οξειδίων:
- Ανυδρίτες οξέων των οποίων το αμέταλλο εμφανίζει μία από τις πιο κοινές καταστάσεις οξείδωσης, όπως σε N2O5, SO3.
- Οξείδια των οποίων το μη μέταλλο δεν εμφανίζει τις πιο κοινές καταστάσεις οξείδωσης. Π.χ.:ΟΧΙ2 , ClO2 .
Διαφορά μεταξύ οξειδίων μετάλλων και οξειδίων μη μετάλλων
Ορισμός
Οξείδια μετάλλων: Τα οξείδια μετάλλων είναι χημικές ενώσεις που περιέχουν ένα μέταλλο και ένα ή περισσότερα άτομα οξυγόνου.
Μη μεταλλικό Οξείδια: Τα μη μεταλλικά οξείδια είναι ενώσεις οξειδίων που σχηματίζονται από μη μεταλλικά στοιχεία.
Φύση
Οξείδια μετάλλων: Το οξείδιο του μετάλλου είναι βασικές ενώσεις.
Μη μεταλλικά οξείδια: Τα μη μεταλλικά οξείδια είναι όξινες ενώσεις.
Αντίδραση με νερό
Οξείδια μετάλλων: Τα οξείδια μετάλλων αντιδρούν με το νερό, σχηματίζοντας βασικά διαλύματα.
Μη μεταλλικό Οξείδια: Τα μη μεταλλικά οξείδια αντιδρούν με το νερό, σχηματίζοντας όξινα διαλύματα.
Δομή
Οξείδια μετάλλων: Τα οξείδια μετάλλων είναι ιοντικές ενώσεις. Ωστόσο, τα οξείδια μετάλλων με μετακατιόντα υψηλότερης οξείδωσης έχουν ομοιοπολική φύση.
Μη μεταλλικά οξείδια: Τα οξείδια μη μετάλλων είναι ομοιοπολικές ενώσεις.
Αντίδραση με οξέα και βάσεις
Οξείδια μετάλλων: Τα οξείδια μετάλλων αντιδρούν με οξέα, σχηματίζοντας άλατα.
Μη μεταλλικό Οξείδια: Τα μη μεταλλικά οξείδια αντιδρούν με βάσεις, σχηματίζοντας άλατα.
Συμπέρασμα
Τα οξείδια μετάλλων είναι ενώσεις που αποτελούνται από ιόντα μετάλλων και ιόντα οξειδίων. Τα μη μεταλλικά οξείδια είναι ενώσεις που αποτελούνται από άτομα μη μετάλλου και άτομα οξυγόνου. Η κύρια διαφορά μεταξύ οξειδίων μετάλλων και οξειδίων μη μετάλλων είναι ότι τα οξείδια μετάλλων είναι βασικές ενώσεις ενώ τα μη μεταλλικά οξείδια είναι όξινες ενώσεις.




