Διαφορά μεταξύ 1 βουτανόλης και 2 βουτανόλης
Κύρια διαφορά – 1 βουτανόλη έναντι 2 βουτανόλη
Η βουτανόλη είναι αλκοόλ. Είναι μια οργανική ένωση που έχει τη λειτουργική ομάδα –ΟΗ συνδεδεμένη με ένα άτομο άνθρακα. Η βουτανόλη έχει τέσσερα άτομα άνθρακα. Ο γενικός τύπος της βουτανόλης είναι C4 H9 OH. Αυτός ο τύπος έχει πέντε ισομερείς δομές. Τα ισομερή είναι μόρια με τον ίδιο μοριακό τύπο αλλά διαφορετικές χημικές δομές. Η 1 βουτανόλη και η 2 βουτανόλη είναι δύο από αυτά τα ισομερή. Η κύρια διαφορά μεταξύ 1 βουτανόλης και 2 βουτανόλης είναι ότι 1 βουτανόλη έχει την ομάδα –ΟΗ συνδεδεμένη με τον τελικό άνθρακα του μορίου, ενώ η 2 βουτανόλη έχει την ομάδα –ΟΗ συνδεδεμένη με το δεύτερο άτομο άνθρακα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η 1 βουτανόλη
– Ορισμός, Χημικές ιδιότητες, Χημική δομή
2. Τι είναι η 2 βουτανόλη
– Ορισμός, Χημικές ιδιότητες, Χημική δομή
3. Ποια είναι η διαφορά μεταξύ 1 βουτανόλης και 2 βουτανόλης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Οινόπνευμα, Βουτανόλη, Χειρικό Κέντρο, Χειρικότητα, Ισομερή, Ρακεμικό Μίγμα, Στερεοϊσομερή
Τι είναι η 1 Butanol
1 Η βουτανόλη είναι μια αλκοόλη που έχει τον χημικό τύπο C4 H9 OH. Η μοριακή μάζα είναι 74,12 g/mol. Το όνομα IUPAC αυτής της ένωσης είναι βουταν-1-όλη . Σε θερμοκρασία δωματίου και πίεση, η 1 βουτανόλη είναι ένα άχρωμο υγρό. Το σημείο βρασμού της 1 βουτανόλης είναι 117,7 °C και το σημείο τήξης -89,8 °C.

Εικόνα 1:Χημική δομή 1 βουτανόλης
Όταν εξετάζουμε τη χημική δομή 1 βουτανόλης, έχει τέσσερα άτομα άνθρακα συνδεδεμένα μεταξύ τους μέσω απλών ομοιοπολικών δεσμών που σχηματίζουν μια αλυσίδα άνθρακα. Ένα άτομο άνθρακα στο άκρο αυτής της ανθρακικής αλυσίδας συνδέεται με μια ομάδα –ΟΗ. Τα υπόλοιπα κενά σημεία της ανθρακικής αλυσίδας καταλαμβάνονται με άτομα υδρογόνου. 1 βουτανόλη έχει γραμμική δομή. Είναι πρωτοταγής αλκοόλη καθώς το άτομο άνθρακα στο οποίο είναι συνδεδεμένη η ομάδα –ΟΗ είναι πρωτεύον άτομο άνθρακα (άτομο άνθρακα που συνδέεται μόνο με ένα άλλο άτομο άνθρακα).
Τι είναι η 2 Butanol
2 Η βουτανόλη είναι μια αλκοόλη που έχει τον χημικό τύπο C4 H9 OH. Η μοριακή μάζα είναι 74,12 g/mol. Το όνομα IUPAC αυτής της ένωσης είναι βουταν-2-όλη . Είναι ένα άχρωμο, εύφλεκτο υγρό σε θερμοκρασία και πίεση δωματίου. Το σημείο βρασμού της 2 βουτανόλης είναι 99,5 °C και το σημείο τήξης είναι -114,7 °C.
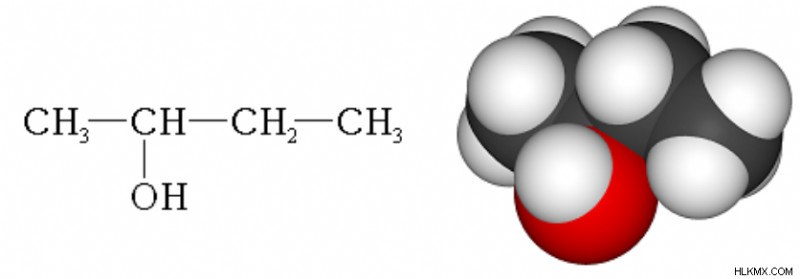
Εικόνα 2:Χημική δομή 2 βουτανόλης
2 η βουτανόλη είναι δευτεροταγής αλκοόλη, καθώς είναι μια ένωση της οποίας η υδροξυλική ομάδα, ‒OH, είναι συνδεδεμένη με ένα κορεσμένο άτομο άνθρακα που έχει δύο άλλα άτομα άνθρακα συνδεδεμένα σε αυτήν. Η 2 βουτανόλη είναι μια χειρόμορφη ένωση. Το άτομο άνθρακα που συνδέεται με την ομάδα –ΟΗ είναι ένα χειρόμορφο κέντρο. Επομένως, αυτό το μόριο έχει στερεοϊσομερή. 2 Η βουτανόλη βρίσκεται συχνά ως ρακεμικό μείγμα στερεοϊσομερών. Τα στερεοϊσομερή της 2 βουτανόλης είναι η (R)-2-βουτανόλη και η (S)-2-βουτανόλη.
Διαφορά μεταξύ 1 βουτανόλης και 2 βουτανόλης
Ορισμός
1 βουτανόλη: 1 Η βουτανόλη είναι μια αλκοόλη που έχει τον χημικό τύπο C4 H9 Ω.
2 βουτανόλη: 2 Η βουτανόλη είναι μια αλκοόλη που έχει τον χημικό τύπο C4 H9 Ω.
Κατηγορία
1 βουτανόλη: 1 Η βουτανόλη είναι μια πρωτογενής αλκοόλη.
2 βουτανόλη: 2 Η βουτανόλη είναι δευτερογενής αλκοόλη.
Σημείο βρασμού
1 βουτανόλη: Το σημείο βρασμού 1 βουτανόλης είναι 117,7 °C.
2 βουτανόλη: Το σημείο βρασμού των 2 βουτανόλης είναι 99,5 °C.
Σημείο τήξης
1 βουτανόλη: Το σημείο τήξης της 1 βουτανόλης είναι -89,8 °C.
2 βουτανόλη: Το σημείο τήξης της 2 βουτανόλης είναι -114,7 °C.
Χειρικότητα
1 βουτανόλη: 1 Η βουτανόλη δεν έχει χειρόμορφα κέντρα.
2 βουτανόλη: 2 Η βουτανόλη έχει χειρόμορφο κέντρο.
Στερεοϊσομερή
1 βουτανόλη: 1 Η βουτανόλη δεν έχει στερεοϊσομερή.
2 βουτανόλη: Η 2 βουτανόλη έχει στερεοϊσομερή.
Όνομα IUPAC
1 βουτανόλη: Η ονομασία IUPAC της 1 βουτανόλης είναι βουταλ-1-όλη.
2 βουτανόλη: Το όνομα IUPAC της 2 βουτανόλης είναι βουταν-2-όλη.
Συμπέρασμα
Η βουτανόλη είναι ένα άχρωμο υγρό σε θερμοκρασία και πίεση δωματίου. Είναι μια ένωση υδρογονάνθρακα. Έχει πέντε κύριες ισομερείς δομές. 1 βουτανόλη και 2 βουτανόλη είναι δύο από αυτά. Η κύρια διαφορά μεταξύ αυτών των δύο μορίων είναι ότι 1 βουτανόλη έχει την ομάδα –ΟΗ συνδεδεμένη με τον τελικό άνθρακα του μορίου, ενώ η 2 βουτανόλη έχει την ομάδα –ΟΗ συνδεδεμένη με το δεύτερο άτομο άνθρακα.
Αναφορά:
1. «1-βουτανόλη». Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
2. “2-βουτανόλη.” Wikipedia, Wikimedia Foundation, 22 Δεκεμβρίου 2017, Διαθέσιμο εδώ.
3. “2-βουτανόλη.” Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
Εικόνα Ευγενική προσφορά:
1. «Επίπεδη δομή βουτανόλης» By Cacycle – Ίδια εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Représentations du butan-2-ol" Από τον Rhadamante ανατέθηκε - Ανάληψη δικής του δουλειάς (με βάση αξιώσεις πνευματικών δικαιωμάτων)., (CC BY-SA 3.0) μέσω Commons Wikimedia




