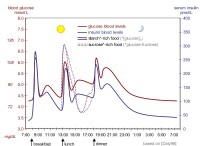
Γιατί το νερό λειτουργεί ως διαλύτης ιοντικών ενώσεων;
1. Πόλη:Το νερό είναι ένα πολικό μόριο, που σημαίνει ότι έχει ένα μερικό θετικό φορτίο στο ένα άκρο (άτομα υδρογόνου) και ένα μερικό αρνητικό φορτίο στο άλλο άκρο (άτομο οξυγόνου). Αυτή η πολικότητα επιτρέπει στα μόρια του νερού να αλληλεπιδρούν με τα ιόντα σε μια ιοντική ένωση.
2. Συγκόλληση υδρογόνου:Τα μόρια νερού μπορούν να σχηματίσουν δεσμούς υδρογόνου με τα ιόντα σε μια ιοντική ένωση. Οι δεσμοί υδρογόνου είναι ισχυρές αλληλεπιδράσεις διπολικής-διπόλης που εμφανίζονται μεταξύ των ηλεκτροαρνητικών ατόμων (όπως το οξυγόνο) και των ατόμων υδρογόνου που συνδέονται με άλλα ηλεκτροαρνητικά άτομα (όπως οξυγόνο, άζωτο ή φθορίνη). Αυτοί οι δεσμοί υδρογόνου συμβάλλουν στη διαλύτη των ιόντων και να τα διατηρήσουν χωριστά στο διάλυμα.
3. Υψηλή διηλεκτρική σταθερά:Το νερό έχει υψηλή διηλεκτρική σταθερά (ε =78,5 στους 25 ° C), πράγμα που σημαίνει ότι έχει μεγάλη ικανότητα αποθήκευσης ηλεκτρικής ενέργειας. Η υψηλή διηλεκτρική σταθερά του νερού εξασθενεί τις ηλεκτροστατικές δυνάμεις μεταξύ των θετικών και των αρνητικών ιόντων σε μια ιοντική ένωση, επιτρέποντας στην ένωση να διαχωριστεί στα συστατικά της ιόντα.
4. Οι αλληλεπιδράσεις ιόντων-διπολικών:τα πολικά μόρια του νερού μπορούν να αλληλεπιδρούν με τα ιόντα μέσω αλληλεπιδράσεων ιόντων-διπόλης. Το θετικό άκρο του μορίου του νερού προσελκύεται από τα αρνητικά ιόντα, ενώ το αρνητικό τέλος του μορίου του νερού προσελκύεται από τα θετικά ιόντα. Αυτές οι αλληλεπιδράσεις βοηθούν να περιβάλλουν τα ιόντα και να τα διατηρούν χωρισμένα στη λύση.
5. Ενυδάτωση ενέργειας:Όταν μια ιοντική ένωση διαλύεται στο νερό, τα μόρια του νερού περιβάλλουν και διαλύουν τα ιόντα, απελευθερώνοντας ενέργεια ενυδάτωσης. Αυτή η ενέργεια απελευθερώνεται λόγω του σχηματισμού δεσμών υδρογόνου και των αλληλεπιδράσεων ιόντων-διπολικών μεταξύ των μορίων του νερού και των ιόντων. Όσο πιο σημαντική είναι η ενέργεια ενυδάτωσης, τόσο πιο διαλυτή η ιοντική ένωση βρίσκεται στο νερό.
Συνολικά, ο συνδυασμός της πολικότητας του νερού, της σύνδεσης υδρογόνου, της υψηλής διηλεκτρικής σταθεράς, των αλληλεπιδράσεων ιόντων-διπολικών και της ενέργειας ενυδάτωσης της δίνει τη δυνατότητα να ενεργεί ως αποτελεσματικός διαλύτης για ιοντικές ενώσεις. Αυτές οι ιδιότητες επιτρέπουν στο νερό να διαλύεται και να διαχωρίζει τις ιοντικές ενώσεις στα αντίστοιχα ιόντα τους, σχηματίζοντας ομοιογενή διαλύματα.