Γνωρίστε τη διαφορά μεταξύ αιθανόλης και αλκοόλ
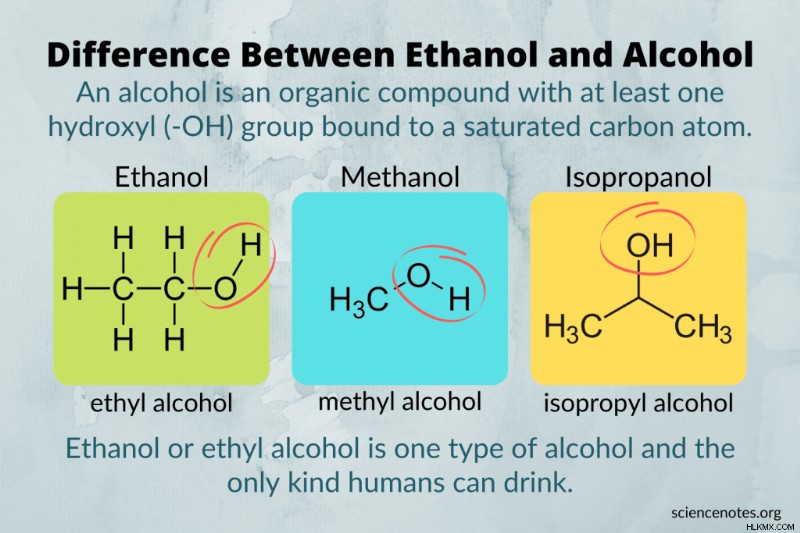
Οι λέξεις αιθανόλη και αλκοόλ δεν είναι εναλλάξιμες. Με απλά λόγια, η αιθανόλη είναι το μόνο είδος αλκοόλ που είναι ασφαλές για κατανάλωση. Η αιθανόλη ονομάζεται επίσης αιθυλική αλκοόλη ή αλκοόλη δημητριακών. Είναι ένα μέλος μιας μεγαλύτερης κατηγορίας μορίων που ονομάζονται αλκοόλες. Όλη η αιθανόλη είναι αλκοόλ. δεν είναι όλο το αλκοόλ αιθανόλη.
Μεθυλική αλκοόλη και ισοπροπυλική αλκοόλη
Εκτός από την αιθανόλη, δύο άλλοι τύποι αλκοόλης που εμφανίζονται συνήθως είναι η μεθυλική αλκοόλη (μεθανόλη) και η ισοπροπυλική αλκοόλη (ισοπροπανόλη). Η μεθανόλη είναι εργαστηριακός διαλύτης, πρόσθετο καυσίμου και αντιψυκτικό. Όπως και άλλα είδη αλκοόλ, απορροφάται εύκολα από το δέρμα. Όμως, η μεθανόλη είναι επικίνδυνα τοξική και μπορεί να προκαλέσει βλάβη στο νευρικό σύστημα και στα όργανα. Η ισοπροπυλική αλκοόλη χρησιμοποιείται ως αλκοόλη εντριβής και εμφανίζεται σε ορισμένα προϊόντα απολύμανσης χεριών. Εξατμίζεται γρήγορα από το δέρμα, δημιουργώντας μια αίσθηση δροσιάς. Η ισοπροπυλική αλκοόλη δεν είναι τόσο τοξική όσο η μεθανόλη, επομένως είναι εγκεκριμένη για χρήση στο δέρμα. Ωστόσο, η ισοπροπυλική αλκοόλη δεν είναι ασφαλής για κατανάλωση. Τα αρχικά αποτελέσματα της κατανάλωσης αιθανόλης, ισοπροπανόλης ή μεθανόλης είναι παρόμοια, αλλά μόνο η αιθανόλη είναι εύλογα ασφαλής για κατανάλωση (και στη συνέχεια, μόνο εάν δεν είναι μετουσιωμένη ή μολυσμένη).
Ορισμός και γεγονότα για το αλκοόλ
Μια αλκοόλη είναι μια χημική ένωση που έχει τουλάχιστον μια ομάδα υδροξυλίου (-ΟΗ) συνδεδεμένη με ένα κορεσμένο άτομο άνθρακα. Ο γενικός χημικός τύπος για μια αλκοόλη είναι Cn H2n+1 Ω. Οι αλκοόλες ταξινομούνται ανάλογα με το πόσοι υποκαταστάτες άνθρακα ή άτομα υδρογόνου (που συμβολίζονται με "R" στον τύπο" συνδέονται με τον άνθρακα με την υδροξυ ομάδα. Μια πρωτογενής αλκοόλη είναι η RCH2 OH , η δευτερογενής αλκοόλη είναι RCH2 OH , και η τριτοταγής αλκοόλη είναι R3 COH.
Οι αλκοόλες είναι πολικές λόγω της παρουσίας της υδροξυλικής ομάδας. Είναι πιο υδατοδιαλυτά από άλλους υδρογονάνθρακες. Η αιθανόλη, η μεθανόλη και η προπανόλη αναμειγνύονται στο νερό. Λόγω του δεσμού υδρογόνου, οι αλκοόλες τείνουν να έχουν υψηλότερα σημεία βρασμού από τους αιθέρες και τους σχετικούς υδρογονάνθρακες. Κάθε αλκοόλη έχει το δικό της χαρακτηριστικό σημείο τήξης, σημείο βρασμού και τοξικότητα. Σε εργαστηριακό περιβάλλον, μερικές φορές είναι εντάξει να αντικαταστήσετε ένα αλκοόλ με ένα άλλο. Στα τρόφιμα, τα ποτά και τα καλλυντικά, το είδος του αλκοόλ δεν πρέπει να αντικαθίσταται.
Ονόματα υδροξυ- έναντι -ολ
Η σύγχυση μεταξύ αιθανόλης και αλκοόλ ξεκίνησε νωρίς, επειδή η πρώτη αλκοόλη που μελετήθηκε ήταν η αιθανόλη. Αρχικά, οι δύο λέξεις χρησιμοποιήθηκαν εναλλακτικά. Ο όρος «αιθανόλη» επινοήθηκε το 1892 συνδυάζοντας τη λέξη αιθάνιο με την κατάληξη -ol. Οι ονομασίες IUPAC των μορίων όπου η ομάδα υδροξυλίου έχει την υψηλότερη προτεραιότητα περιέχουν το επίθημα -ol. Εάν η ομάδα υδροξυλίου δεν είναι η υψηλότερη προτεραιότητα, η χημική ονομασία έχει συνήθως ένα πρόθεμα υδροξυλίου. Τα σάκχαρα είναι παραδείγματα μορίων που περιέχουν ομάδες υδροξυλίου, αλλά δεν ονομάζονται χρησιμοποιώντας το πρόθεμα υδροξυ- ή το επίθημα -όλη.
Αναφορές
- IUPAC (2006). «Οινόπνευμα». Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). doi:10.1351/goldbook.A00204
- Multhauf, Robert (1966). The Origins of Chemistry . Λονδίνο.