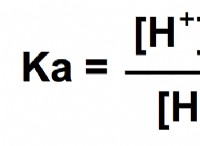Ποια ιόντα παράγονται όταν η αμμωνία διαλύεται στο νερό;
Ο ιονισμός της αμμωνίας στο νερό μπορεί να αντιπροσωπεύεται από την ακόλουθη χημική εξίσωση:
NH3 + H2O ⇌ NH4 + + OH-
Σε αυτή την αντίδραση, ένα μόριο αμμωνίας (NH3) δέχεται ένα ιόν υδρογόνου (Η+) από ένα μόριο νερού (Η2Ο), σχηματίζοντας ιόν αμμωνίου (NH4+). Ταυτόχρονα, το μόριο νερού που δωρίζει το ιόν υδρογόνου απελευθερώνει ένα ιόν υδροξειδίου (ΟΗ-).
Η σταθερά ισορροπίας (KB) για τον ιονισμό της αμμωνίας σε νερό σε θερμοκρασία δωματίου (25 ° C) είναι περίπου 1,8 x 10-5. Αυτό υποδεικνύει ότι ο ιονισμός της αμμωνίας είναι μια σχετικά αδύναμη διαδικασία, που σημαίνει ότι η πλειονότητα των μορίων αμμωνίας παραμένει un-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on-on.
Η παρουσία ιόντων αμμωνίου και υδροξειδίου στο διάλυμα συμβάλλει στις βασικές ιδιότητες της υδατικής αμμωνίας. Τα ιόντα υδροξειδίου που παράγονται κατά τη διάρκεια του ιονισμού μπορούν να αντιδράσουν με άλλα οξέα που υπάρχουν στο διάλυμα, οδηγώντας σε αύξηση του ρΗ και μείωση της οξύτητας του διαλύματος.