Τι είναι το Ka, η σταθερά διάστασης οξέος;
Βασικές έννοιες
Σε αυτό το σεμινάριο θα μάθετε για τη σταθερά διάστασης οξέος (Ka) και τις εφαρμογές της σε άλλα θέματα της χημείας. Θα μάθετε πώς να συνδέετε το Ka και το pKa καθώς και τη σχέση μεταξύ Ka και PH.
Θέματα που καλύπτονται σε άλλα άρθρα
- Χωρητικότητα buffer και υπολογισμοί
- Πώς να υπολογίσετε τον τύπο μοριακότητας και μοριακότητας
- Φυσικές και χημικές ιδιότητες του νερού
- Τι είναι η σταθερά ισορροπίας
- Αντιδράσεις εξουδετέρωσης οξέων βάσεων
Τι είναι το Ka;
Το Ka, ή η σταθερά διάστασης οξέος χρησιμοποιείται για τη διαφοροποίηση ισχυρών και αδύναμων οξέων. Εάν ένα οξύ διαχωρίζεται περισσότερο, η τιμή για το Ka θα μειωθεί και αντίστροφα εάν το οξύ είναι λιγότερο πιθανό να διασπαστεί στο νερό, η τιμή Ka θα είναι μικρότερη. Έτσι, για παράδειγμα, ένα ισχυρό οξύ όπως το υδροχλωρικό οξύ (HCl) θα έχει υψηλότερη σταθερά διάστασης, Ka, από το υδροφθορικό οξύ ασθενούς οξέος (HF). Αυτό συμβαίνει επειδή τα αδύναμα οξέα είναι λιγότερο πιθανό να ιονιστούν στο νερό, υπάρχουν κυρίως ως μόρια, ενώ τα ισχυρά οξέα θα υπάρχουν ως επί το πλείστον ιόντα στο νερό.
Το Ka είναι επίσης η σταθερά ισορροπίας της αντίδρασης διάστασης ενός οξέος. Αυτή είναι μια ποσοτική τιμή για την ισχύ ενός οξέος σε διάλυμα. Η σταθερά διάστασης οξέος δεν έχει μονάδες.
Το Ka είναι ίσο με τα προϊόντα πάνω από τα αντιδρώντα .
Βήματα για τον υπολογισμό του Ka
Ακολουθούν τα βήματα για τον υπολογισμό του Ka:
- Λάβετε το γινόμενο των συγκεντρώσεων των ιόντων που έχουν διαχωριστεί.
- Στη συνέχεια διαιρέστε αυτόν τον αριθμό με τη συγκέντρωση του αρχικού σας οξέος. Ένας εύκολος τρόπος να το θυμάστε αυτό είναι "προϊόντα πάνω από αντιδρώντα".
Πρώην. HBr → H+ Br
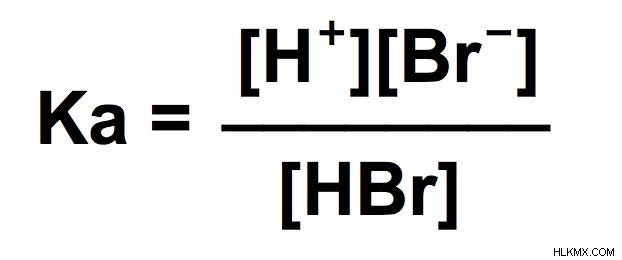
Οι αγκύλες γύρω από το ιόν υδρογόνου, το ιόν βρωμίου και το υδροβρωμικό οξύ υποδεικνύουν μοριακότητα. Έτσι, για να βρούμε μια ποσοτική τιμή για το Ka αυτής της αντίδρασης, θα χρειαστεί να έχουμε τις μοριακές τιμές καθενός από αυτά τα στοιχεία.
Ουσιαστικά, όσο μεγαλύτερη είναι η τιμή για το Ka, τόσο περισσότερο το οξύ θα διαχωριστεί. Όσο περισσότερο ένα οξύ διασπάται, τόσο ισχυρότερο είναι το οξύ. Όσο ισχυρότερο είναι το οξύ, τόσο μεγαλύτερη είναι η τιμή του Ka. Αντίθετα, τα πιο αδύναμα οξέα θα έχουν γενικά χαμηλότερες τιμές Ka από τα ισχυρότερα οξέα, επειδή τα αδύναμα οξέα αποσυνδέονται μόνο εν μέρει, πράγμα που σημαίνει ότι υπάρχουν περισσότερα αντιδραστήρια έναντι των προϊόντων.
Τιμή ισορροπίας (τιμή K)
Η τιμή ισορροπίας μιας αντίδρασης θα απεικονίσει την αναλογία μεταξύ των προϊόντων της αντίδρασης διαιρούμενη με τα αντιδρώντα. Εάν η τιμή Κ για μια αντίδραση είναι υψηλή, η αντίδραση θα ευνοήσει τα προϊόντα και θα προχωρήσει στην κατεύθυνση του προλόγου. Ομοίως, εάν η τιμή Κ της αντίδρασης είναι χαμηλή, η αντίδραση θα ευνοήσει τα αντιδρώντα και θα προχωρήσει προς την πίσω κατεύθυνση.
Αντιδράσεις οξέος-βάσης
Το Ka μιας αντίδρασης οξέος-βάσης μπορεί να υπολογιστεί εάν κάποιος γνωρίζει τις τιμές pKa των αντιδρώντων και των προϊόντων. Αυξήστε το 10 στην ισχύ της διαφοράς στις τιμές PKa στο συζευγμένο οξύ και το αντιδρών οξύ.

Εάν η αντίδραση έχει ένα ασθενές συζυγές οξύ και ένα ισχυρό αντιδρών οξύ, η σταθερά ισορροπίας θα είναι υψηλή. Αυτό σημαίνει ότι η αντίδραση θα οδηγηθεί κυρίως στην ολοκλήρωση. Αντίθετα, εάν μια αντίδραση οξέος-βάσης έχει ένα ισχυρό οξύ ως συζευγμένο οξύ, η σταθερά ισορροπίας θα ήταν απίστευτα χαμηλή.
Υπολογισμός Ph από το Ka
Η σταθερή τιμή διάστασης οξέος μπορεί να χρησιμοποιηθεί σε πολλά διαφορετικά σενάρια, σε ορισμένες περιπτώσεις μπορεί να χρησιμοποιηθεί για τον υπολογισμό του Ph. Ας χρησιμοποιήσουμε το παράδειγμα ενός διαλύματος 0,20M του HBr.
- Το πρώτο μας βήμα θα πρέπει να είναι να γράψουμε τη χημική αντίδραση για τον ιονισμό που σχηματίζει ιόντα Η – HBr ⇌H+ Br
- Το δεύτερο βήμα είναι να γράψετε την έκφραση ισορροπίας για αυτήν την αντίδραση, η οποία είναι τα προϊόντα πάνω από τα αντιδρώντα.
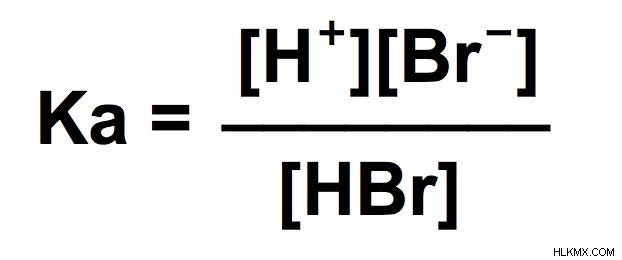
- Στη συνέχεια, θα πρέπει να χρησιμοποιήσουμε τα γνωστά μας για να δημιουργήσουμε ένα ICE διάγραμμα για επίλυση της συγκέντρωσης του ιόντος υδρογόνου.
| Αρχικό | 0,20 M | 0 | 0 |
| Αλλαγή | -x | +x | +x |
| Ισορροπία | (.20 – x)M | x | x |
- Αφού δημιουργήσουμε το διάγραμμα ICE, πρέπει να χρησιμοποιήσουμε αυτές τις τιμές για να ορίσουμε το X. Χρησιμοποιήστε την παραπάνω έκφραση ισορροπίας, συνδέστε τις τιμές σας και λύστε για το X. Αυτό θα μας δώσει μια τιμή για τη συγκέντρωση του ιόντος υδρογόνου.
- Τέλος, αφού ο τύπος για το PH είναι ίσος με -log[H] βρίσκουμε ότι το PH είναι ίσο με 5,00.
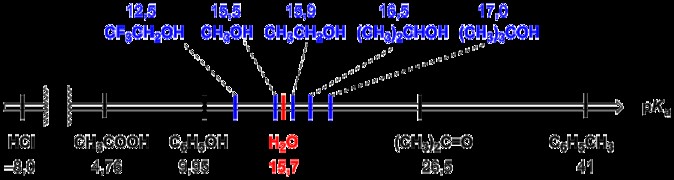
Σχέση pKa και Ka
Οι τιμές pKa και Ka είναι συνήθως πιο χρήσιμες όταν προσδιορίζεται σε ποιο βαθμό ένα οξύ θα ιονιστεί σε ένα διάλυμα. Όπως η σταθερά διάστασης οξέος, το Kb είναι η σταθερά διάστασης βάσης. Η σταθερά διάστασης οξέος και η σταθερά διάστασης βάσης σχετίζονται μέσω της σταθεράς ιόντων για το νερό, Kw.
Άρα, Ka x Kb =Kw
Κάθε φορά που βλέπουμε το πεζό p μπροστά από μια σταθερά στη χημεία, συνήθως μέση -καταγραφή αυτής της τιμής. Εφόσον γνωρίζουμε ότι το Ka είναι η σταθερά διάστασης οξέος, το pKa απλώς σημαίνει -log της σταθεράς τιμής διάστασης οξέος. Τα οξέα συνήθως διασπώνται σύμφωνα με τις ακόλουθες εξισώσεις,
HA + H2 O ⇆ A + H3 O (Το γράμμα Α δηλώνει οξύ)
Ka =[H+][A-]/ [HA] (Η κάθετο υποδηλώνει διαίρεση), εδώ μπορούμε να δούμε τα προϊόντα της αντίδρασης πάνω από τα αντιδρώντα.
pKa =– log Ka (σημειώστε ότι στην προηγούμενη ερώτηση λάβαμε μια τιμή για το Ka έτσι, τώρα μπορούμε να βρούμε την τιμή για το pKa).
Μπορεί να παρατηρήσετε από πριν ότι ένα ισχυρό οξύ θα παράγει μια μεγαλύτερη σταθερή τιμή διάστασης οξέος επειδή το οξύ είναι σχεδόν πλήρως διαχωρισμένο. Εφόσον, η ιονισμένη μορφή του οξέος ευνοείται στη διάσταση ενός ισχυρού οξέος, η αντίδραση θα ευνοήσει την εξέλιξη προς τα αριστερά (την πλευρά των αντιδράσεων). Το pKa μπορεί να μας πει το ίδιο πράγμα ακριβώς με την αντίστροφη σειρά. Έτσι, ένα μικρότερο pKa θα δείξει ένα ισχυρότερο οξύ.