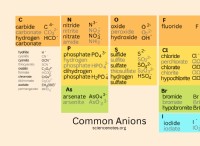
Τα αλκαλικά διαλύματα είναι πάντα ασφαλή για να πίνουν;
Η κατανάλωση εξαιρετικά αλκαλικών λύσεων μπορεί να προκαλέσει αρκετές ανεπιθύμητες ενέργειες, όπως:
1. Ερεθισμός και εγκαύματα: Τα αλκαλικά διαλύματα μπορούν να ερεθίσουν και να κάψουν το στόμα, το λαιμό και τον οισοφάγο λόγω της διαβρωτικής τους φύσης.
2. Ανισορροπία ηλεκτρολύτη: Η κατανάλωση υπερβολικών ποσοτήτων αλκαλικών διαλυμάτων μπορεί να διαταράξει την ισορροπία των ηλεκτρολυτών του σώματος, οδηγώντας σε καταστάσεις όπως η υπονατριαιμία (χαμηλά επίπεδα νατρίου) ή η υποκαλιαιμία (χαμηλά επίπεδα καλίου).
3. Πεπτικά προβλήματα: Τα αλκαλικά διαλύματα μπορούν να μεταβάλλουν το ρΗ του στομάχου, να επηρεάζουν την πέψη και ενδεχομένως να οδηγήσουν σε ναυτία, έμετο ή κοιλιακό πόνο.
4. Τα αλκαλικά διαλύματα που έρχονται σε επαφή με το δέρμα μπορούν να προκαλέσουν ερεθισμό, ερυθρότητα και ακόμη και χημικά εγκαύματα.
5. Η παρατεταμένη κατανάλωση υψηλής αλκαλικής διαλύματος μπορεί να ασκήσει πίεση στους νεφρούς και ενδεχομένως να οδηγήσει σε νεφρική βλάβη ή δυσλειτουργία.
Είναι σημαντικό να σημειωθεί ότι η ασφάλεια των αλκαλικών διαλυμάτων εξαρτάται από διάφορους παράγοντες, όπως το επίπεδο pH, η συγκέντρωση και η κατάσταση υγείας του ατόμου. Η διαβούλευση με έναν ιατρικό επαγγελματία ή έναν τοξικολόγο συνιστάται πριν από την κατανάλωση οποιωνδήποτε αλκαλικών λύσεων, ειδικά εκείνων με ρΗ έξω από το ασφαλές εύρος.