Διαφορά μεταξύ SO2 και SO3
Κύρια διαφορά – SO2 εναντίον SO3
SO2 και SO3 είναι ανόργανες χημικές ενώσεις που σχηματίζονται από το συνδυασμό ατόμων θείου και ατόμων οξυγόνου. SO2 σημαίνει διοξείδιο του θείου , και SO3 σημαίνει τριοξείδιο του θείου . Αυτές είναι αέριες ενώσεις. Έχουν διαφορετικές χημικές και φυσικές ιδιότητες. Αυτές οι ενώσεις ονομάζονται οξείδια του θείου αφού σχηματίζονται από την αντίδραση μεταξύ θείου και O2 μόρια. Η κύρια διαφορά μεταξύ SO2 και SO3 είναι αυτό SO2 έχει δύο άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου ενώ το SO3 έχει τρία άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το SO2
– Ορισμός, Χημική δομή και ιδιότητες, κατάσταση οξείδωσης
2. Τι είναι το SO3
– Ορισμός, χημική δομή και ιδιότητες, παραγωγή θειικού οξέος
3. Ποια είναι η διαφορά μεταξύ SO2 και SO3
– Σύγκριση βασικών διαφορών
Βασικοί όροι:όξινη βροχή, μοναχικό ζεύγος ηλεκτρονίων, οξυγόνο, κατάσταση οξείδωσης, θείο, διοξείδιο του θείου, θειικό οξύ, τριοξείδιο του θείου

Τι είναι το SO2
SO2 σημαίνει διοξείδιο του θείου . Το διοξείδιο του θείου είναι μια αέρια ένωση που αποτελείται από άτομα θείου και οξυγόνου. Ο χημικός τύπος του διοξειδίου του θείου είναι SO2 . Επομένως, αποτελείται από ένα άτομο θείου συνδεδεμένο με δύο άτομα οξυγόνου μέσω ομοιοπολικών δεσμών. Ένα άτομο οξυγόνου μπορεί να σχηματίσει διπλό δεσμό με το άτομο θείου. Ως εκ τούτου, το άτομο θείου είναι το κεντρικό άτομο της ένωσης. Δεδομένου ότι το στοιχείο θείου έχει 6 ηλεκτρόνια στο εξώτατο τροχιακό του μετά τον σχηματισμό δύο διπλών δεσμών με τα άτομα οξυγόνου, απομένουν άλλα 2 ηλεκτρόνια. Αυτά μπορούν να λειτουργήσουν ως ένα μοναχικό ζεύγος ηλεκτρονίων. Αυτό καθορίζει τη γεωμετρία του SO2 μόριο ως γωνιακή γεωμετρία. SO2 είναι πολικό λόγω της γεωμετρίας του (γωνιακό) και της παρουσίας ενός μοναχικού ζεύγους ηλεκτρονίων.
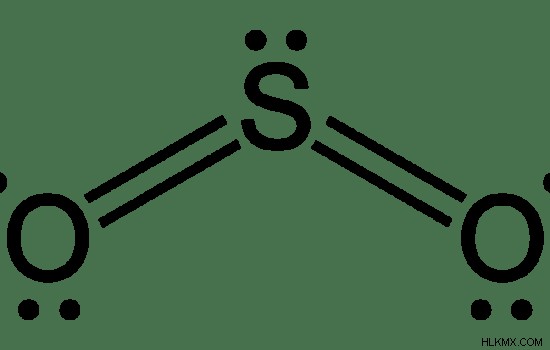
Εικόνα 1:Χημική δομή του SO2
Το διοξείδιο του θείου θεωρείται τοξικό αέριο. Επομένως, εάν υπάρχει SO2 στην ατμόσφαιρα, θα είναι ένδειξη ατμοσφαιρικής ρύπανσης. Αυτό το αέριο έχει μια πολύ ερεθιστική μυρωδιά. Η μοριακή μάζα του διοξειδίου του θείου είναι 64 g/mol. Είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου. Το σημείο τήξης είναι περίπου -71 C ενώ το σημείο βρασμού είναι -10 C.
Η κατάσταση οξείδωσης του θείου στο διοξείδιο του θείου είναι +4. Επομένως, το διοξείδιο του θείου μπορεί επίσης να παραχθεί με την αναγωγή ενώσεων που αποτελούνται από άτομα θείου που βρίσκονται σε υψηλότερη κατάσταση οξείδωσης. Ένα τέτοιο παράδειγμα είναι η αντίδραση μεταξύ χαλκού και θειικού οξέος. Εδώ, το θείο στο θειικό οξύ βρίσκεται σε κατάσταση οξείδωσης +6. Επομένως, μπορεί να μειωθεί σε κατάσταση οξείδωσης +4 του διοξειδίου του θείου.
Το διοξείδιο του θείου μπορεί να χρησιμοποιηθεί στην παραγωγή θειικού οξέος το οποίο έχει πολλές εφαρμογές στη βιομηχανική και εργαστηριακή κλίμακα. Το διοξείδιο του θείου είναι επίσης καλός αναγωγικός παράγοντας. Δεδομένου ότι η κατάσταση οξείδωσης του θείου είναι +4 σε διοξείδιο του θείου, μπορεί εύκολα να οξειδωθεί σε κατάσταση οξείδωσης +6, η οποία επιτρέπει την αναγωγή μιας άλλης ένωσης.
Τι είναι το SO3
SO3 σημαίνει τριοξείδιο του θείου. Το τριοξείδιο του θείου είναι μια στερεή ένωση που αποτελείται από ένα άτομο θείου συνδεδεμένο με τρία άτομα οξυγόνου. Ο χημικός τύπος του διοξειδίου του θείου είναι SO3 . Κάθε οξυγόνο έχει σχηματίσει διπλό δεσμό με το άτομο του θείου. Το άτομο του θείου βρίσκεται στο κέντρο του μορίου. Δεδομένου ότι το θείο έχει 6 ηλεκτρόνια στο εξώτατο τροχιακό του, αφού σχηματίσει τρεις διπλούς δεσμούς με τα άτομα οξυγόνου, δεν υπάρχουν άλλα ηλεκτρόνια που παραμένουν στο άτομο θείου. Αυτό καθορίζει τη γεωμετρία του SO3 μόριο ως τριγωνική επίπεδη γεωμετρία. SO3 είναι μη πολικό λόγω της γεωμετρίας του (τριγωνικό επίπεδο) και της απουσίας μοναχικού ζεύγους ηλεκτρονίων.

Εικόνα 2:Χημική δομή του SO3
Η μοριακή μάζα του τριοξειδίου του θείου είναι 80,057 g/mol. Το σημείο τήξης του SO3 είναι περίπου 16,9 °C ενώ το σημείο βρασμού είναι 45C. Σε θερμοκρασία δωματίου και πίεση, το τριοξείδιο του θείου είναι μια λευκή κρυσταλλική στερεή ένωση που θα ατμίζει στον αέρα. Έχει μια πικάντικη μυρωδιά. Η κατάσταση οξείδωσης του θείου στο τριοξείδιο του θείου είναι +6.
Στην αέρια μορφή του, το τριοξείδιο του θείου είναι ατμοσφαιρικός ρύπος και αποτελεί σημαντικό συστατικό στις όξινες βροχές. Ωστόσο, το τριοξείδιο του θείου είναι πολύ σημαντικό για την παραγωγή θειικού οξέος σε βιομηχανική κλίμακα. Αυτό συμβαίνει επειδή το τριοξείδιο του θείου είναι η ανυδρίτη μορφή του θειικού οξέος.
SO3(l) + H2 O(l) → H2 SO4(l)
Η παραπάνω αντίδραση είναι πολύ γρήγορη και εξώθερμη. Επομένως, θα πρέπει να χρησιμοποιούνται μέθοδοι ελέγχου όταν χρησιμοποιείται τριοξείδιο του θείου για βιομηχανική παραγωγή θειικού οξέος. Επιπλέον, το τριοξείδιο του θείου είναι ένα απαραίτητο αντιδραστήριο στη διαδικασία σουλφόνωσης.
Διαφορά μεταξύ SO2 και SO3
Ορισμός
SO2 : SO2 σημαίνει διοξείδιο του θείου.
SO3 : SO3 σημαίνει τριοξείδιο του θείου.
Φύση
SO2 : SO2 είναι μια αέρια ένωση που αποτελείται από άτομα θείου και οξυγόνου.
SO3 : SO3 είναι μια στερεή ένωση που αποτελείται από ένα άτομο θείου συνδεδεμένο με τρία άτομα οξυγόνου.
Μοριακή μάζα
SO2 : Η μοριακή μάζα του SO2 είναι 64 g/mol.
SO3 : Η μοριακή μάζα του SO3 είναι 80,057 g/mol.
Σημείο τήξης και σημείο βρασμού
SO2 : Το σημείο τήξης του SO2 είναι περίπου -71°C ενώ το σημείο βρασμού είναι -10°C.
SO3 : Το σημείο τήξης του SO3 είναι περίπου 16,9 °C ενώ το σημείο βρασμού είναι 45 °C.
Κατάσταση οξείδωσης
SO2 : Η κατάσταση οξείδωσης του θείου στο SO2 είναι +4.
SO3 : Η κατάσταση οξείδωσης του θείου στο SO3 είναι +6.
Οξείδωση
SO2 : SO2 μπορεί να οξειδωθεί περαιτέρω.
SO3 : SO3 δεν μπορεί να οξειδωθεί περαιτέρω.
Πολικότητα
SO2 : SO2 είναι πολικό λόγω της γεωμετρίας του (γωνιακό) και της παρουσίας ενός μοναχικού ζεύγους ηλεκτρονίων.
SO3 : SO3 είναι μη πολικό λόγω της γεωμετρίας του (τριγωνικό επίπεδο) και της απουσίας μοναχικού ζεύγους ηλεκτρονίων.
Συμπέρασμα
SO2 και SO3 είναι ανόργανες ενώσεις που ονομάζονται οξείδια του θείου. SO2 είναι μια αέρια ένωση σε θερμοκρασία δωματίου. SO3 είναι μια στερεή (κρυσταλλική) ένωση σε θερμοκρασία δωματίου. Η κύρια διαφορά μεταξύ SO2 και SO3 είναι αυτό SO2 έχει δύο άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου ενώ το SO3 έχει τρία άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου.
Αναφορά:
1. «Διοξείδιο του θείου». Wikipedia, Ίδρυμα Wikimedia, 3 Ιανουαρίου 2018, Διαθέσιμο εδώ.
2. «ΤΡΙΟΞΕΙΔΙ ΤΟΥ ΘΕΙΟΥ». Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
3. «Η μοριακή γεωμετρία του SO3, η δομή του Lewis και η πολικότητα εξηγούνται». Geometry of Molecules, 21 Ιουλίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. "Sulfur-dioxide-ve-B-2D" By Ben Mills – Δική του εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "SO3 Sulfur Trioxide" Από Yikrazuul – Δική του εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia