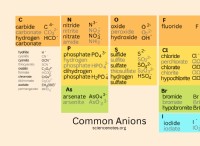
Τι έχουν κοινό το ισχυρό οξύ με την ιοντική ένωση;
1. Πλήρης διάσταση:Τα ισχυρά οξέα διαχωρίζονται πλήρως στο νερό, απελευθερώνοντας όλα τα ιόντα υδρογόνου τους (Η+). Ομοίως, οι ιοντικές ενώσεις διαχωρίζονται στα συστατικά τους ιόντα όταν διαλύονται σε νερό.
2. Υψηλή αγωγιμότητα:Τα ισχυρά οξέα και οι ιοντικές ενώσεις είναι και οι δύο καλοί αγωγοί ηλεκτρικής ενέργειας σε υδατικά διαλύματα. Η παρουσία ελεύθερα κινούμενων ιόντων και στις δύο περιπτώσεις επιτρέπει τη ροή του ηλεκτρικού ρεύματος.
3. Αντιδράσεις οξέος-βάσης:Τα ισχυρά οξέα δίνουν ιόντα υδρογόνου (Η+) σε αντιδράσεις οξέος-βάσης, οδηγώντας στον σχηματισμό ιόντων υδρογόνου (Η3Ο+). Στην περίπτωση ιοντικών ενώσεων, ορισμένα ιόντα μπορούν να συμμετέχουν σε αντιδράσεις οξέος-βάσης, συμβάλλοντας στη συνολική όξιη ή βασική φύση του διαλύματος.
4. Αντίδραση με μέταλλα:Τα ισχυρά οξέα αντιδρούν με ενεργά μέταλλα για την παραγωγή αερίου υδρογόνου (Η2) και ένα άλας. Ομοίως, ορισμένες ιοντικές ενώσεις αντιδρούν με μέταλλα, υποβάλλονται σε αντιδράσεις οξειδοαναγωγής και σχηματίζοντας νέες ενώσεις.
5. Τιμή ρΗ:Τα ισχυρά οξέα έχουν χαμηλή τιμή ρΗ, συνήθως κάτω από 7, λόγω της υψηλής συγκέντρωσης ιόντων υδρογόνου. Ομοίως, τα διαλύματα ιοντικών ενώσεων μπορούν να έχουν ποικίλες τιμές ρΗ ανάλογα με τη φύση των παρόντων ιόντων.
6. Διασύνης:Τα ισχυρά οξέα είναι διαβρωτικά στη φύση, πράγμα που σημαίνει ότι μπορούν να βλάψουν τον ιστό και τα υλικά. Ομοίως, ορισμένες ιοντικές ενώσεις μπορούν να παρουσιάσουν διαβρωτικές ιδιότητες λόγω της αντιδραστικότητας των ιόντων τους.
7. Σχηματισμός αλάτων:Τα ισχυρά οξέα αντιδρούν με βάσεις ή ανθρακικά μέταλλα για να σχηματίσουν άλατα και νερό. Οι ιοντικές ενώσεις, εξ ορισμού, είναι άλατα που αποτελούνται από θετικά φορτισμένα ιόντα (κατιόντα) και αρνητικά φορτισμένα ιόντα (ανιόντα).
Ενώ αυτά τα κοινά χαρακτηριστικά υπάρχουν μεταξύ ισχυρών οξέων και ιοντικών ενώσεων, είναι σημαντικό να σημειωθεί ότι δεν είναι όλες οι ιοντικές ενώσεις δεν είναι όξινες και δεν είναι όλα τα ισχυρά οξέα να είναι ιοντικές ενώσεις. Ωστόσο, η κατανόηση αυτών των ομοιότητας βοηθά στην κατανόηση της χημικής συμπεριφοράς και των ιδιοτήτων τους σε υδατικά διαλύματα.