Κατάλογος μη μετάλλων
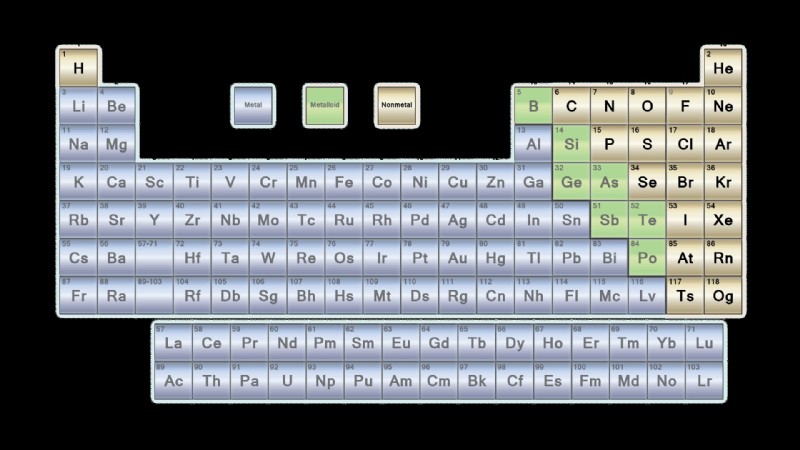
Τα μη μεταλλικά στοιχεία καταλαμβάνουν την επάνω δεξιά γωνία του περιοδικού πίνακα. Τα αμέταλλα περιλαμβάνουν την ομάδα των αμέταλλων, τα αλογόνα και τα ευγενή αέρια. Αυτά τα στοιχεία έχουν παρόμοιες χημικές ιδιότητες μεταξύ τους που τα διακρίνουν από τα στοιχεία που θεωρούνται μέταλλα.
Ομάδες μη μετάλλων
Η ομάδα μη μεταλλικών στοιχείων είναι ένα υποσύνολο των αμέταλλων. Η ομάδα των μη μεταλλικών στοιχείων αποτελείται από υδρογόνο, άνθρακα, άζωτο, οξυγόνο, φώσφορο, θείο και σελήνιο. Το υδρογόνο δρα ως αμέταλλο σε κανονικές θερμοκρασίες και πίεση και είναι γενικά αποδεκτό ότι ανήκει στην ομάδα των αμέταλλων.
Τα αλογόνα είναι αμέταλλα της ομάδας 7 του περιοδικού πίνακα. Τα άτομα αυτών των στοιχείων έχουν την κατάσταση οξείδωσης -1. Τα στοιχεία στην κορυφή της ομάδας είναι αέρια, αλλά γίνονται υγρά και στερεά που κινούνται προς τα κάτω στην ομάδα. Τα αλογόνα είναι φθόριο, χλώριο, βρώμιο, ιώδιο και αστατίνη. Οι ιδιότητες του tennessine δεν είναι γνωστές. Το Tennessine μπορεί να είναι αλογόνο ή μπορεί να είναι μεταλλοειδές.
Τα ευγενή αέρια είναι σχετικά μη αντιδραστικά αέρια που βρίσκονται στην ομάδα 8 (η τελευταία στήλη) του πίνακα περιόδου. Τα ευγενή αέρια είναι το ήλιο, το νέο, το αργό, το κρυπτόν, το ξένο, το ραδόνιο και το ογκανεσσόν. Είναι πιθανό το oganesson να μην είναι αέριο σε θερμοκρασία δωματίου.
Λίστα μη μετάλλων
Αυτή είναι μια λίστα με τα μη μεταλλικά στοιχεία κατά σειρά αυξανόμενου ατομικού αριθμού.
| NUMBER | ΣΥΜΒΟΛΟ | ΣΤΟΙΧΕΙΟ |
| 1 | H | Υδρογόνο |
| 2 | Αυτός | Ήλιο |
| 6 | Γ | Άνθρακας |
| 7 | Δ | Άζωτο |
| 8 | O | Οξυγόνο |
| 9 | F | Φθόριο |
| 10 | Δεν | Νέον |
| 15 | P | Φώσφορος |
| 16 | S | Θείο |
| 17 | Cl | Χλώριο |
| 18 | Αρ | Αργόν |
| 34 | Δείτε | Σελήνιο |
| 35 | Br | Βρώμιο |
| 36 | Κρ | Krypton |
| 53 | I | Ιώδιο |
| 54 | Xe | Xenon |
| 85 | Σε | Αστατίνη |
| 86 | Rn | Ραδόνιο |
| 117 | Ts | Τενεσί |
| 118 | Og | Oganesson |
Ιδιότητες των μη μετάλλων
Οι ιδιότητες των μη μετάλλων περιλαμβάνουν:
- θαμπό, όχι γυαλιστερό
- κακός αγωγός θερμότητας
- κακός αγωγός του ηλεκτρισμού
- ενέργειες υψηλού ιονισμού
- υψηλή ηλεκτραρνητικότητα
- μη εύπλαστο ή όλκιμο, συνήθως εύθραυστο
- χαμηλότερη πυκνότητα (σε σύγκριση με μέταλλα)
- χαμηλότερο σημείο τήξης και σημείο βρασμού (σε σύγκριση με μέταλλα)
- αποκτούν ηλεκτρόνια στις αντιδράσεις (έχουν αρνητική κατάσταση οξείδωσης)
- συχνά πολύχρωμο σε στερεά κατάσταση
Λίστα μη μεταλλικών χρήσεων
Σε αντίθεση με τα μέταλλα, τα αμέταλλα δεν έχουν καθολικές εφαρμογές. Ωστόσο, εμφανίζονται μαζί σε ορισμένες εφαρμογές:
- Απαραίτητο για τη ζωή (άνθρακας, υδρογόνο, άζωτο, οξυγόνο, θείο, χλώριο, φώσφορος)
- Λιπάσματα (υδρογόνο, άζωτο, φώσφορος, θείο, χλώριο, σελήνιο)
- Ψυκτικά και κρυογονικά (υδρογόνο, ήλιο, άζωτο, οξυγόνο, φθόριο, νέον)
- Βιομηχανικά οξέα (άνθρακας, άζωτο, φθόριο, φώσφορος, θείο, χλώριο)
- Λέιζερ και λαμπτήρες
- Ιατρικά και φαρμακευτικά προϊόντα
Τα αμέταλλα σχηματίζουν πολλές ενώσεις. Στην πραγματικότητα, οι περισσότερες ενώσεις που συναντάτε περιέχουν αμέταλλα. Εμφανίζονται σε νερό, τρόφιμα, υφάσματα, πλαστικά και άλλα καθημερινά είδη.
Αναφορές
- Addison, W. E. (1964) The Allotropy of the Elements . Oldbourne Press:Λονδίνο.
- Bettelheim, F.A.; Brown, W.H.; Campbell, Μ.Κ.; Farrell, S.O.; Torres, O.J. (2016). Εισαγωγή στη Γενική, Οργανική και Βιοχημεία (11η έκδ.). Cengage Learning:Βοστώνη. ISBN 978-1-285-86975-9.
- Emsley, J. (1971). Η ανόργανη χημεία των μη μετάλλων . Methuen Εκπαιδευτικό:Λονδίνο. ISBN 0423861204.
- Steudel, R. (1977). Χημεία των μη μετάλλων:με μια εισαγωγή στην ατομική δομή και τους χημικούς δεσμούς . Αγγλική έκδοση F.C. Nachod &J.J. Ζούκερμαν. Βερολίνο:Walter de Gruyter. ISBN 3110048825.




