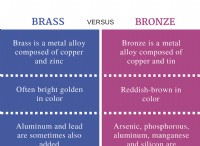
Ποιος παράγοντας εκτός από την ηλεκτροαρνητικότητα καθορίζει αν ένα μόριο ως σύνολο είναι πολικό ή όχι;
Εδώ είναι γιατί:
* Ηλεκτροργατιστικότητα μας λέει για την κατανομή των ηλεκτρονίων μέσα σε ένα δεσμό. Εάν δύο άτομα έχουν διαφορετικές ηλεκτροθεραπευτικές περιοχές, τα ηλεκτρόνια θα τραβηχτούν πιο κοντά στο πιο ηλεκτροαρνητικό άτομο, δημιουργώντας μια ροπή διπόλης εντός του ομολόγου.
* Μοριακή γεωμετρία Περιγράφει τη διάταξη τρισδιάστατη διάταξη των ατόμων σε ένα μόριο.
Ακόμη και αν ένα μόριο έχει πολικούς δεσμούς, μπορεί να είναι nonpolar Συνολικά εάν οι διπολικές στιγμές των μεμονωμένων ομολόγων ακυρώσουν ο ένας τον άλλον Λόγω της γεωμετρίας του μορίου.
Εδώ είναι ένα παράδειγμα:
* διοξείδιο του άνθρακα (CO2) Έχει δύο πολικούς δεσμούς μεταξύ άνθρακα και οξυγόνου. Ωστόσο, το μόριο είναι γραμμικό. Οι δύο διπόλες δείχνουν σε αντίθετες κατευθύνσεις, ακυρώνουν τέλεια ο ένας τον άλλον. Επομένως, το CO2 είναι ένα μη πολικό μόριο.
Σε αντίθεση:
* νερό (H2O) έχει δύο πολικούς δεσμούς μεταξύ οξυγόνου και υδρογόνου. Το μόριο έχει μια λυγισμένη γεωμετρία, που σημαίνει ότι οι διπολικές στιγμές των ομολόγων δεν ακυρώνουν. Αυτό έχει ως αποτέλεσμα μια καθαρή διπολική στιγμή για ολόκληρο το μόριο, καθιστώντας το νερό A Polar μόριο.
Συνοπτικά, ακόμη και με πολικούς δεσμούς, ένα μόριο μπορεί να είναι μη πολικό εάν η γεωμετρία του επιτρέπει στα μεμονωμένα δίπολα των δεσμών να ακυρώσουν ο ένας τον άλλον.