Πώς επηρεάζει η αύξηση της θερμοκρασίας τη χημική αντίδραση;
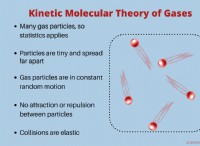
* Αυξημένη μοριακή κίνηση: Οι υψηλότερες θερμοκρασίες προκαλούν τη μετακίνηση των μορίων και συγκρούονται πιο συχνά. Αυτές οι συγκρούσεις είναι αυτό που οδηγούν τις χημικές αντιδράσεις.
* Περισσότερη ενέργεια για ενεργοποίηση: Οι χημικές αντιδράσεις απαιτούν μια ορισμένη ελάχιστη ποσότητα ενέργειας, που ονομάζεται ενέργεια ενεργοποίησης, να συμβεί. Η αυξημένη θερμοκρασία παρέχει περισσότερα μόρια με αρκετή ενέργεια για να ξεπεραστεί το φράγμα ενεργοποίησης και να αντιδράσει.
* Αυξημένη αποτελεσματικότητα σύγκρουσης: Οι υψηλότερες θερμοκρασίες όχι μόνο αυξάνουν τη συχνότητα των συγκρούσεων αλλά και τις καθιστούν πιο πιθανό να είναι αποτελεσματικοί, πράγμα που σημαίνει ότι τα μόρια συγκρούονται με αρκετή ενέργεια και τον σωστό προσανατολισμό για να αντιδράσουν.
Η σχέση μεταξύ θερμοκρασίας και ρυθμού αντίδρασης:
Ο ρυθμός χημικής αντίδρασης συχνά σχετίζεται εκθετικά με τη θερμοκρασία. Αυτό σημαίνει ότι ακόμη και οι μικρές αλλαγές στη θερμοκρασία μπορούν να επηρεάσουν σημαντικά το πόσο γρήγορα προχωράει μια αντίδραση.
Η εξίσωση Arrhenius:
Η εξίσωση Arrhenius περιγράφει μαθηματικά αυτή τη σχέση:
k =a * e^(-ea/rt)
Οπου:
* k: Σταθερά ποσοστού της αντίδρασης
* a: Προ-εκθετικός παράγοντας (που σχετίζεται με τη συχνότητα σύγκρουσης)
* ea: Ενέργεια ενεργοποίησης
* r: Ιδανική σταθερά αερίου
* t: Θερμοκρασία στο Kelvin
Αυτή η εξίσωση δείχνει ότι η σταθερά ρυθμού (και επομένως ο ρυθμός αντίδρασης) αυξάνεται εκθετικά καθώς αυξάνεται η θερμοκρασία (t).
Εξαιρέσεις και σκέψεις:
* Αντιδράσεις ισορροπίας: Ενώ η θερμοκρασία γενικά επιταχύνει τις αντιδράσεις, μπορεί να μετατοπίσει το σημείο ισορροπίας των αναστρέψιμων αντιδράσεων. Η κατεύθυνση της μετατόπισης εξαρτάται από το αν η αντίδραση είναι εξωθερμική ή ενδοθερμική.
* αντιδράσεις αποσύνθεσης: Ορισμένες αντιδράσεις, όπως οι αντιδράσεις αποσύνθεσης, μπορεί να επιβραδυνθούν σε υψηλότερες θερμοκρασίες λόγω της αστάθειας των αντιδραστηρίων.
* Επιδράσεις καταλύτη: Οι καταλύτες μειώνουν την ενέργεια ενεργοποίησης μιας αντίδρασης, καθιστώντας την πιο γρήγορα σε οποιαδήποτε δεδομένη θερμοκρασία.
Συνοπτικά:
Η αύξηση της θερμοκρασίας επιταχύνει γενικά τις χημικές αντιδράσεις με την αύξηση της μοριακής κίνησης, παρέχοντας περισσότερη ενέργεια για να ξεπεραστεί ο φράγμα ενεργοποίησης και να καταστεί πιο αποτελεσματικές οι συγκρούσεις. Αυτή η σχέση περιγράφεται από την εξίσωση Arrhenius. Ωστόσο, υπάρχουν εξαιρέσεις και εκτιμήσεις που πρέπει να γνωρίζετε, ιδίως με αναστρέψιμες αντιδράσεις και το ρόλο των καταλυτών.