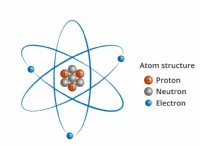
Πώς είναι τα μόρια διαφορετικά από τα ιόντα ή τα άτομα;
άτομα
* Τα δομικά στοιχεία: Τα άτομα είναι οι θεμελιώδεις μονάδες της ύλης. Αποτελούνται από έναν πυρήνα (που περιέχουν πρωτόνια και νετρόνια) που περιβάλλεται από ένα σύννεφο ηλεκτρονίων.
* Βασικές μονάδες: Είναι η μικρότερη μονάδα ενός στοιχείου που διατηρεί τις χημικές ιδιότητες αυτού του στοιχείου.
* Παραδείγματα: Υδρογόνο (Η), οξυγόνο (Ο), άνθρακα (C)
μόρια
* Δύο ή περισσότερα άτομα που συνδέονται μαζί: Τα μόρια σχηματίζονται όταν δύο ή περισσότερα άτομα συνδέονται χημικά μεταξύ τους.
* Σταθερές μονάδες: Είναι γενικά σταθερά και έχουν τις δικές τους μοναδικές ιδιότητες.
* Παραδείγματα: Νερό (H₂O), διοξείδιο του άνθρακα (CO₂), γλυκόζη (C₆H₁₂o₆)
ιόντα
* φορτισμένα άτομα ή μόρια: Τα ιόντα σχηματίζονται όταν ένα άτομο ή ένα μόριο κερδίζει ή χάνει ένα ή περισσότερα ηλεκτρόνια, με αποτέλεσμα ένα καθαρό ηλεκτρικό φορτίο.
* Καθεμένα και ανιόντες: Εάν ένα άτομο χάσει ηλεκτρόνια, γίνεται θετικά φορτισμένο και ονομάζεται κατιόν. Εάν ένα άτομο κερδίσει ηλεκτρόνια, γίνεται αρνητικά φορτισμένο και ονομάζεται ανιόν.
* Παραδείγματα: Ιόν νατρίου (Na⁺), ιόν χλωριούχου (CL⁻), θειικό ιόν (SO₄2⁻)
Βασικές διαφορές σε έναν πίνακα:
| Χαρακτηριστικό | Άτομα | Μόρια | Ιόντα |
| --- | --- | --- | --- |
| Ορισμός | Θεμελιώδεις μονάδες ύλης | Δύο ή περισσότερα άτομα που συνδέονται μαζί | Φορτισμένα άτομα ή μόρια |
| χρέωση | Ουδέτερο | Ουδέτερο | Θετικό ή αρνητικό |
| Παραδείγματα | Υδρογόνο (Η), οξυγόνο (Ο) | Νερό (H₂O), διοξείδιο του άνθρακα (CO₂) | Ιόν νατρίου (Na⁺), ιόν χλωριούχου (CL⁻) |
| σταθερότητα | Μπορεί να υπάρχει ανεξάρτητα | Γενικά σταθερό | Γενικά σταθερό |
| δεσμός | Δεν ισχύει | Ομοιοπολικοί ή ιοντικοί δεσμοί | Δεν ισχύει (εκτός από ιοντικές ενώσεις)
Σημαντική σημείωση:
* Ιωνικές ενώσεις σχηματίζονται όταν τα κατιόντα και τα ανιόντα προσελκύουν ο ένας τον άλλον λόγω των αντίθετων χρεώσεων τους. Αυτές οι ενώσεις δεν είναι τεχνικά "μόρια" επειδή δεν περιλαμβάνουν την ανταλλαγή ηλεκτρονίων (ομοιοπολική σύνδεση).
* Πολυατομικά ιόντα είναι ιόντα που περιέχουν περισσότερα από ένα άτομο. Για παράδειγμα, το θειικό ιόν (SO₄2⁻) αποτελείται από ένα άτομο θείου και τέσσερα άτομα οξυγόνου.
Επιτρέψτε μου να ξέρω αν έχετε περισσότερες ερωτήσεις!