Τι συμβαίνει όταν αφαιρείτε ένα νετρόνιο από ένα άτομο;
Όταν αφαιρείτε ή προσθέτετε ένα νετρόνιο στον πυρήνα ενός ατόμου, η ουσία που προκύπτει είναι ένας νέος τύπος του ίδιου στοιχείου και ονομάζεται ισότοπο.
Ό,τι βλέπετε γύρω σας αποτελείται από ύλη και όλη η ύλη αποτελείται από άτομα. Μπορούν τα άτομα να διασπαστούν περαιτέρω; Σίγουρα. Τα άτομα αποτελούνται από πρωτόνια, νετρόνια, ηλεκτρόνια και μια δέσμη διαφορετικών υποατομικών σωματιδίων που οι περισσότεροι από εμάς δεν γνωρίζουμε.
Τώρα, εάν τα πάντα αποτελούνται από άτομα, και τα ίδια τα άτομα αποτελούνται από υποατομικά σωματίδια, μια αλλαγή στον συνδυασμό των υποατομικών σωματιδίων θα οδηγήσει σε ένα νέο, διαφορετικό είδος ύλης; Σίγουρα το κάνει.
Εάν αφαιρούσατε ένα ηλεκτρόνιο από ένα άτομο, θα σας έμενε ένα θετικά φορτισμένο ιόν, έτοιμο να συνδεθεί με ένα άλλο αντίθετα φορτισμένο ιόν. Εάν ένα πρωτόνιο αφαιρεθεί ή προστεθεί σε ένα άτομο, σχηματίζεται ένα εντελώς νέο στοιχείο (θα πρέπει επίσης να προσθέσετε ή να αφαιρέσετε τον ίδιο αριθμό νετρονίων για να διατηρήσετε τον πυρήνα σταθερό). Ωστόσο, τι συμβαίνει όταν αφαιρείτε ένα ουδέτερα φορτισμένο νετρόνιο από έναν ατομικό πυρήνα; Ένα νέο στοιχείο, ίσως;
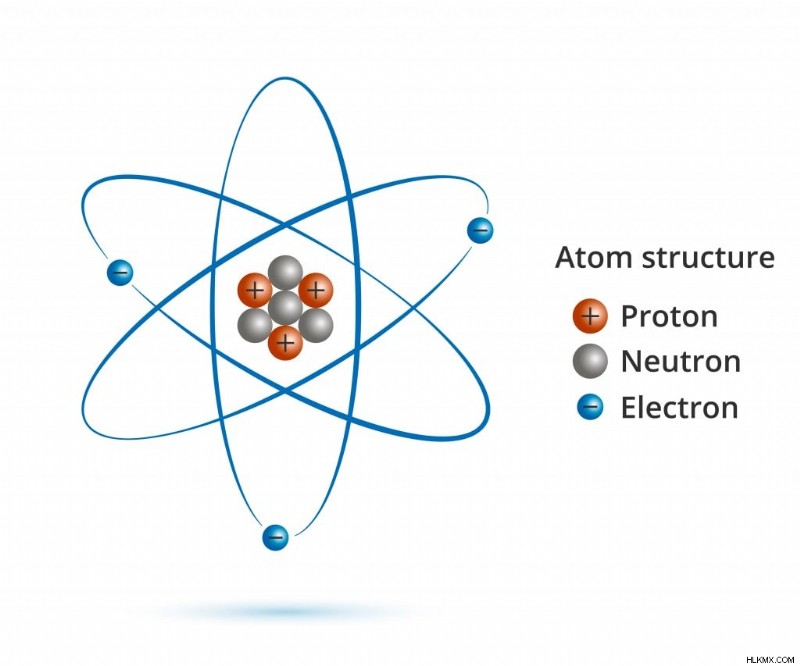
Ένα άτομο περιέχει κυρίως πρωτόνια, ηλεκτρόνια και νετρόνια. Η προσθήκη ή η αφαίρεση οποιουδήποτε από αυτά τα σωματίδια αλλάζει τις ιδιότητες και την ταυτότητα του ατόμου. (Φωτογραφία:Vector FX/ Shutterstock)
Ισότοπα
Όταν αφαιρείτε ή προσθέτετε ένα νετρόνιο στον πυρήνα ενός ατόμου, δεν λαμβάνετε τεχνικά ένα νέο στοιχείο, αλλά έχετε έναν νέο τύπο του ίδιου στοιχείου στο χέρι σας. Αυτός ο νέος τύπος ονομάζεται «ισότοπο» του στοιχείου. Τα ισότοπα ορίζονται επίσημα ως στοιχεία με τον ίδιο αριθμό πρωτονίων, αλλά διαφορετικό αριθμό νετρονίων στον πυρήνα. Ένας άλλος ορισμός των ισοτόπων τα ορίζει ως άτομα με τον ίδιο ατομικό αριθμό (αριθμός πρωτονίων), αλλά διαφορετικούς ατομικούς αριθμούς μάζας (το άθροισμα των νετρονίων και των πρωτονίων ενός ατόμου). Τα ισότοπα ενός στοιχείου έχουν επίσης τον ίδιο αριθμό ηλεκτρονίων.
Εντάξει, ας χρησιμοποιήσουμε τα iPhone που κυκλοφόρησαν πρόσφατα για να κατανοήσουμε την έννοια των ισοτόπων με πιο προσιτό τρόπο. Η Apple κυκλοφόρησε πρόσφατα τρεις νέες συσκευές στη σειρά Apple iPhone, συγκεκριμένα, iPhone 11, iPhone 11 Pro και iPhone 11 Pro Max. Το Pro και το Pro Max δεν είναι παρά μια διαφορετική παραλλαγή ή τύπος του iPhone 11. Τα δύο μπορεί να αναγνωριστούν ως τύπος του iPhone 11 επειδή χρησιμοποιούν το ίδιο τσιπ A13 Bionic ή απλώς επειδή κυκλοφόρησαν το έτος 2019.
Όλα τα στοιχεία αναγνωρίζονται αποκλειστικά με βάση τον ατομικό τους αριθμό, δηλαδή τον αριθμό των πρωτονίων στον πυρήνα. Έτσι, παρόμοια με τα iPhone, στοιχεία με τον ίδιο αριθμό πρωτονίων (iPhone με τσιπ A13), αλλά διαφορετικό αριθμό νετρονίων (διαφορετικός αριθμός καμερών ή μέγεθος μπαταρίας) προσδιορίζονται ως διαφορετικοί τύποι του ίδιου στοιχείου, αντί για εντελώς νέο στοιχείο.
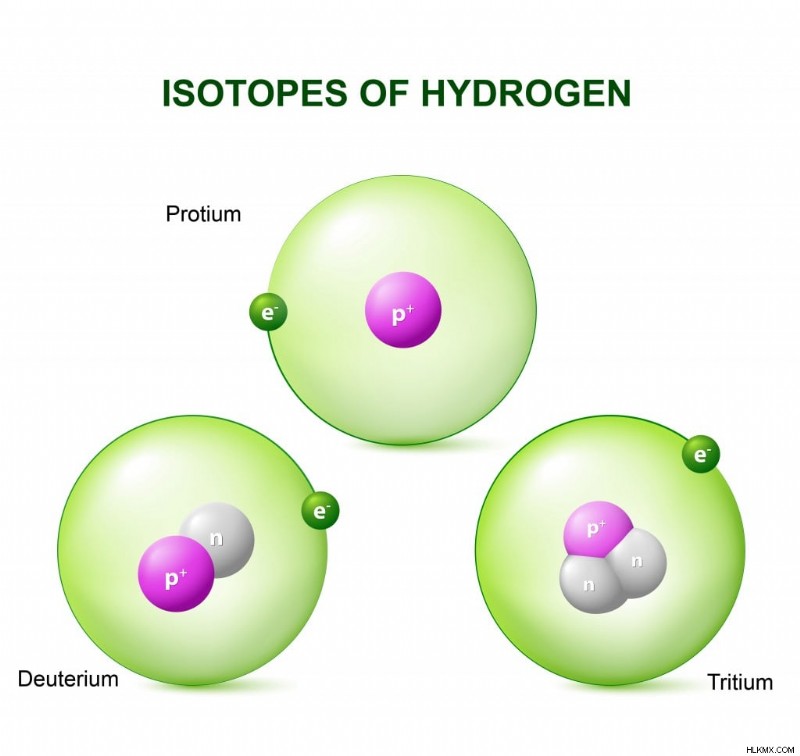
Το υδρογόνο έχει τρία φυσικά ισότοπα, με το καθένα να έχει ένα νετρόνιο περισσότερο από το άλλο, αλλά τον ίδιο αριθμό πρωτονίων. (Φωτογραφία :Designua/ Shutterstock)
Ιστορία των ισοτόπων
Η ύπαρξη ραδιενεργών ισοτόπων διακρίθηκε για πρώτη φορά από τον Frederick Soddy, έναν ραδιοχημικό, το έτος 1913, ενώ μελετούσε ραδιενεργούς καταρράκτες (μια σειρά ραδιενεργών διασπάσεων). Ο Soddy βρήκε 40 διαφορετικά είδη στοιχείων (που αναφέρονται ως ραδιοστοιχεία) μεταξύ ουρανίου και μολύβδου. Ωστόσο, ο περιοδικός πίνακας επέτρεπε μόνο 11 στοιχεία μεταξύ των δύο. Σε μια προσπάθεια να τοποθετήσουν αυτά τα 40 στοιχεία στον περιοδικό πίνακα, ο Frederick Soddy και ο Kazimierz Fajans κατέληξαν στη θεωρία της ραδιενεργής μετατόπισης.
Η θεωρία πρότεινε ότι η διάσπαση άλφα (ραδιενεργή διάσπαση στην οποία ένα άτομο εκπέμπει έναν πυρήνα ηλίου, δηλ. 2 πρωτόνια και 2 νετρόνια) παράγει ένα στοιχείο δύο θέσεις στα αριστερά του μητρικού στοιχείου στον περιοδικό πίνακα, ενώ η διάσπαση βήτα (εκπομπή ενός ηλεκτρόνιο ή ποζιτρόνιο) οδηγεί σε ένα στοιχείο μια θέση στα δεξιά του γονέα.
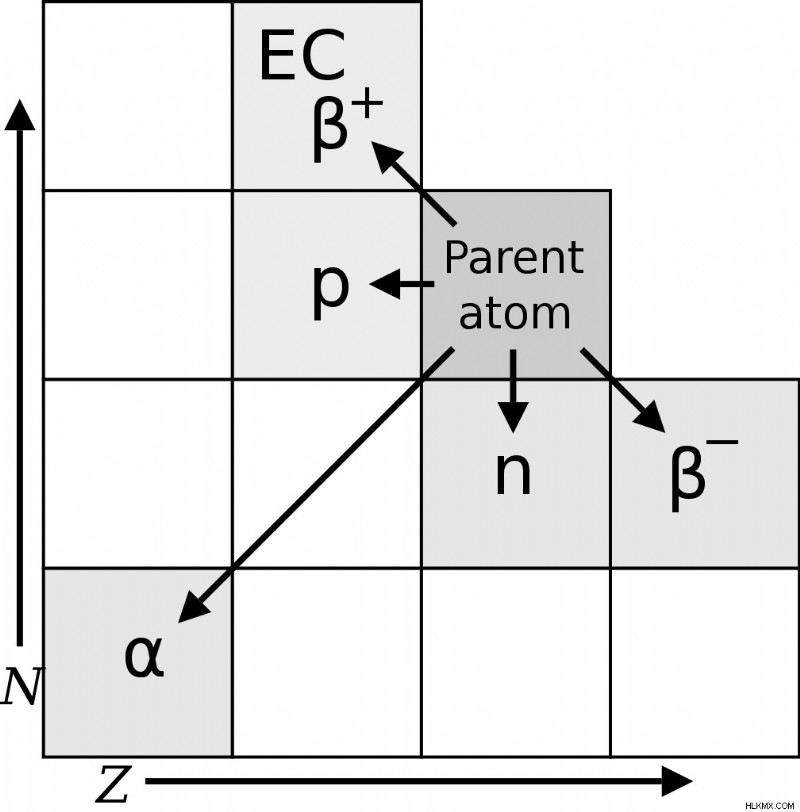
Μια οπτική αναπαράσταση των στοιχείων που σχηματίζονται μετά από κάθε τύπο αποσύνθεσης. Εδώ, το N είναι ο αριθμός των νετρονίων και το Z αντιπροσωπεύει τον ατομικό αριθμό. (Φωτογραφία:MarsRover/Wikimedia Commons)
Ωστόσο, ο Soddy παρατήρησε ότι ορισμένα ραδιοστοιχεία είχαν διαφορετικά ατομικά βάρη/μάζα, αλλά διατηρούσαν τις χημικές ιδιότητες του μητρικού τους στοιχείου και, επομένως, θα έπρεπε να καταλαμβάνουν την ίδια θέση στον περιοδικό πίνακα. Η Margaret Todd, μια φίλη του Frederick Soddy, επινόησε τον όρο «ισότοπα» για αυτά τα ραδιοστοιχεία. Η λέξη ισότοπο είναι ελληνική για «στο ίδιο μέρος». Ο Soddy τιμήθηκε με το βραβείο Νόμπελ Χημείας το 1921 για τη συμβολή του στην κατανόηση των ραδιενεργών στοιχείων και στην έρευνα και ανακάλυψη ισοτόπων. Ο J. J. Thomson βρήκε τα πρώτα σταθερά ισότοπα ενός στοιχείου το έτος 1913.
Η διαφορά στις ιδιότητες μεταξύ των ισοτόπων
Για λόγους απλότητας, μπορούμε να χωρίσουμε τις ιδιότητες ενός στοιχείου σε δύο μέρη - χημικές ιδιότητες και φυσικές ιδιότητες. Οι χημικές ιδιότητες είναι η ικανότητα και η τάση ενός στοιχείου, και επομένως των ατόμων του, να υφίστανται χημικές αντιδράσεις για να σχηματίσουν ενώσεις ή άλλα στοιχεία. Αυτές οι ιδιότητες καθορίζονται από τον αριθμό των ηλεκτρονίων που υπάρχουν στο άτομο. Δεδομένου ότι τα ισότοπα ενός στοιχείου έχουν διαφορετικό αριθμό νετρονίων, αλλά τον ίδιο αριθμό ηλεκτρονίων, έχουν παρόμοιες χημικές ιδιότητες. Ωστόσο, τα ισότοπα του υδρογόνου αποτελούν εξαίρεση.
Από την άλλη πλευρά, οι φυσικές ιδιότητες, όπως το σημείο βρασμού και το σημείο τήξης ενός στοιχείου, εξαρτώνται από τον ατομικό μαζικό αριθμό του. Μια διαφορά στον μαζικό αριθμό προσδίδει διαφορετικές φυσικές ιδιότητες σε ένα ισότοπο από το μητρικό του. Ωστόσο, οι πυρηνικές ιδιότητες των ισοτόπων διαφέρουν μεταξύ τους και αποτελούν επίσης τη βάση της ταξινόμησής τους.
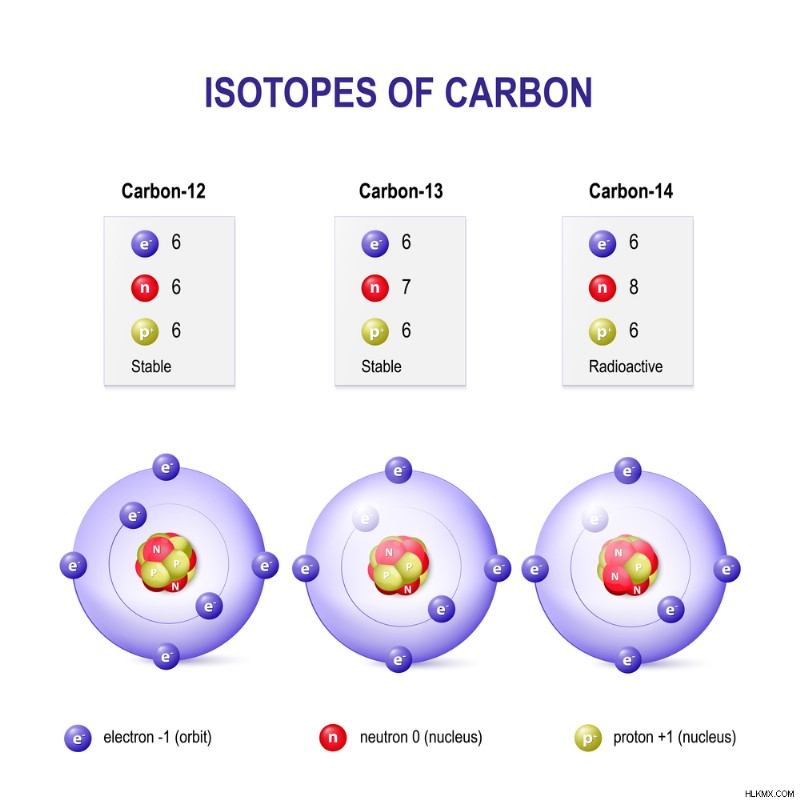
Ο άνθρακας έχει τρία φυσικά ισότοπα. Ο άνθρακας-12 και ο άνθρακας-13 είναι σταθερά ισότοπα ενώ ο άνθρακας 14 είναι ραδιενεργός. (Φωτογραφία :Designua/ Shutterstock)
Τα ισότοπα ταξινομούνται με βάση τη σταθερότητά τους ή την τάση τους προς αποσύνθεση. Από τα 339 φυσικά ισότοπα, περίπου 252 θεωρούνται σταθερά. Ωστόσο, μόνο 146 από αυτά είναι πραγματικά σταθερά, ενώ τα άλλα 106 είναι θεωρητικά επιρρεπείς στη φθορά. Δεδομένου ότι δεν έχουν γίνει τέτοιες παρατηρήσεις μέχρι στιγμής, τις θεωρούμε παρατηρητικά σταθερές.
Επίσης, από τα 339 φυσικά ισότοπα, τα 286 είναι αρχέγονα, δηλαδή υπάρχουν από τον σχηματισμό του ηλιακού συστήματος. Το συνολικό σύνολο των ισοτόπων που έχουν επιβεβαιωθεί μέχρι στιγμής, μαζί με αυτά που δημιουργήθηκαν τεχνητά, ξεπερνά τα 3.300. Πάνω από 2.400 από αυτά έχουν χρόνο ημιζωής μικρότερο από 60 λεπτά. Κάθε στοιχείο έχει ένα ή περισσότερα ραδιενεργά ισότοπα, ενώ στοιχεία με ατομικό αριθμό μεγαλύτερο από 83 έχουν μόνο ραδιενεργά ισότοπα.
Συμπέρασμα
Αυτό μπορεί να είναι ένα συναρπαστικό θέμα, αλλά η αφαίρεση νετρονίων από τον πυρήνα ενός ατόμου δεν είναι περίπατος στο πάρκο. Τα ισότοπα βρίσκονται κυρίως στις χρησιμοποιημένες ράβδους των πυρηνικών αντιδραστήρων, ως υποπροϊόντα πυρηνικών αντιδράσεων. Παράγονται τεχνητά βομβαρδίζοντας σταθερά άτομα με σωματίδια άλφα (πυρήνας ηλίου) σε έναν επιταχυντή σωματιδίων. Άλλες μέθοδοι περιλαμβάνουν την ακτινοβόληση μητρικών ισοτόπων με νετρόνια σε έναν πυρηνικό αντιδραστήρα ή τη χρήση κυκλοτρονίου.
Τα ραδιενεργά ισότοπα βρίσκουν χρήση σε διάφορα πεδία. Το πιο ελπιδοφόρο είναι η πειθαρχία της πυρηνικής ιατρικής και η θεραπεία του καρκίνου. Οι βιομηχανικές χρήσεις περιλαμβάνουν την εσωτερική ασφάλεια, την ακτινοβολία τροφίμων, τη βιομηχανική ακτινογραφία, τη γεωλογία, την αστρονομία κ.λπ. Καθώς συνεχίζουμε να ανακαλύπτουμε περισσότερα ισότοπα στο μέλλον, ποιος ξέρει τι νέες χρήσεις θα βρούμε!




