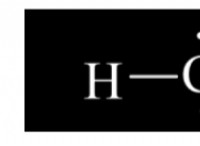
Τι είναι ένας ιοντικός δεσμός;
Τι είναι η ηλεκτροαρνητικότητα;
Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό. Σκεφτείτε το ως "ρυμουλκό του πολέμου" μεταξύ των ατόμων.
Πώς σχηματίζονται οι ιοντικοί δεσμοί:
1. Μεταφορά ηλεκτρονίων: Σε ένα ιοντικό δεσμό, ένα άτομο (συνήθως ένα μέταλλο) "χάνει" ένα ή περισσότερα ηλεκτρόνια, καθιστώντας ένα θετικά φορτισμένο ιόν (κατιόν). Το άλλο άτομο (τυπικά μη μέταλλο) "κερδίζει" αυτά τα ηλεκτρόνια, καθιστώντας ένα αρνητικά φορτισμένο ιόν (ανιόν).
2. Ηλεκτροστατική έλξη: Τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον έντονα λόγω των ηλεκτροστατικών δυνάμεων, σχηματίζοντας τον ιονικό δεσμό.
Βασικά χαρακτηριστικά των ιοντικών δεσμών:
* υψηλά σημεία τήξης και βρασμού: Οι ισχυρές ηλεκτροστατικές δυνάμεις απαιτούν πολλή ενέργεια για να σπάσουν.
* Συνήθως στερεό σε θερμοκρασία δωματίου: Η άκαμπτη δομή που σχηματίζεται από τα ιόντα είναι δύσκολο να διαταραχθεί.
* καλοί αγωγοί ηλεκτρικής ενέργειας σε λιωμένες ή διαλυμένες καταστάσεις: Όταν λιωθεί ή διαλυθεί, τα ιόντα γίνονται ελεύθερα να κινηθούν, επιτρέποντάς τους να διεξάγουν ηλεκτρική ενέργεια.
* Γενικά διαλυτό σε πολικούς διαλύτες όπως το νερό: Η πολική φύση του νερού μπορεί να αλληλεπιδράσει με τα φορτισμένα ιόντα, να σπάσει τους ιοντικούς δεσμούς και να διαλύσει την ένωση.
Παράδειγμα:
Το χλωριούχο νάτριο (NaCl), το κοινό αλάτι του τραπεζιού, είναι ένα παράδειγμα ιοντικής ένωσης. Το νάτριο (Na) χάνει ένα ηλεκτρόνιο για να γίνει Na+, ενώ το χλώριο (CL) κερδίζει ένα ηλεκτρόνιο για να γίνει cl-. Αυτά τα αντίθετα φορτισμένα ιόντα στη συνέχεια προσελκύονται μεταξύ τους, σχηματίζοντας τον ιονικό δεσμό.
Συνοπτικά:
Οι ιοντικοί δεσμοί σχηματίζονται μεταξύ ατόμων με μεγάλη διαφορά ηλεκτροαρνητικότητας, με αποτέλεσμα τη μεταφορά ηλεκτρονίων, τον σχηματισμό αντίθετα φορτισμένων ιόντων και την ισχυρή ηλεκτροστατική έλξη μεταξύ τους. Αυτό οδηγεί σε ενώσεις με χαρακτηριστικές ιδιότητες όπως υψηλά σημεία τήξης και καλή ηλεκτρική αγωγιμότητα όταν λιωθεί ή διαλυθεί.