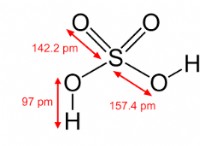
Πόσα ηλεκτρόνια μετοχών ατόμου υδρογόνου;
Εδώ είναι γιατί:
* Hydrogen only has one proton and one electron. Αυτό σημαίνει ότι έχει μόνο χώρο για ένα ηλεκτρόνιο στο ενιαίο κέλυφος ηλεκτρονίων του.
* Το υδρογόνο μπορεί να σχηματίσει έναν ομοιοπολικό δεσμό με ένα άλλο άτομο. Αυτό σημαίνει ότι θα μοιραστεί το ενιαίο ηλεκτρόνιο του με ένα άλλο άτομο, σχηματίζοντας ένα κοινό ζευγάρι ηλεκτρονίων. Αυτός είναι ο τρόπος με τον οποίο σχηματίζει μόρια όπως το H₂O (νερό).
Έτσι, ενώ το υδρογόνο μπορεί να μοιράζεται το ηλεκτρόνιο του σε έναν ομοιοπολικό δεσμό, δεν έχει * πολλαπλά ηλεκτρόνια για να μοιραστεί.