Θειικό Οξύ:Ιδιότητες, Δομή &Χρήσεις
Έχετε διαβάσει για οξέα και βάσεις μέχρι τώρα. Ας ελπίσουμε ότι θα συναντήσετε πολλά πειράματα που περιλαμβάνουν οξέα και βάσεις. Έτσι, γνωρίζετε και τις ιδιότητές τους. Με την ίδια σειρά, έχετε κάνει ακόμα πειράματα με θειικό οξύ; Έχετε αναρωτηθεί ποτέ γιατί ο δάσκαλός σας σας εμπόδισε να προσθέσετε νερό στο συμπυκνωμένο οξύ; Γνωρίζετε ότι το θειικό οξύ χρησιμοποιείται και στο σπίτι;
Στην επόμενη ενότητα, θα μάθετε περισσότερα για το θειικό οξύ, τις ιδιότητες και τις χρήσεις του.
Τι είναι το θειικό οξύ;
Το θείο σχηματίζει πολλά οξοξέα όπως H2SO3, H2S2O3, H2S2O4, H2SO5, κ.λπ. Μερικά από αυτά είναι σταθερά, ενώ μερικά από αυτά είναι ασταθή και δεν μπορούν να απομονωθούν. Αυτά τα οξοξέα του θείου υπάρχουν στην υδατική μορφή ή στη μορφή των αλάτων τους.
Το θειικό οξύ είναι ένα από αυτά. Από όλα τα οξοξέα του θείου, είναι το πιο σημαντικό οξύ. Το θειικό οξύ μερικές φορές είναι επίσης γνωστό ως διόξινο θειικό, έλαιο βιτριόλης, ματ οξύ, οξύ μπαταρίας, οξύ εμβάπτισης και πολλές άλλες ονομασίες ανάλογα με τη χρήση θειικού οξέος. Στην αρχαιότητα, το θειικό οξύ ονομαζόταν «έλαιο βιτριόλης» καθώς παρασκευαζόταν με απόσταξη πράσινου βιτριόλης (θειικός σίδηρος), FeSO4.7H2O.
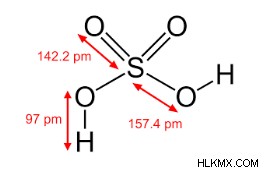
Δομή του θειικού οξέος
Είναι διβασικό οξύ και επομένως περιέχει δύο ομάδες ΟΗ. Και οι δύο αυτές ομάδες συνδέονται απευθείας με το άτομο S. Ως εκ τούτου, το θειικό οξύ, H2SO4, μπορεί επίσης να αντιπροσωπεύεται από τον τύπο (OH)2SO2. Η παρουσία δύο ομάδων ΟΗ επαληθεύεται από το γεγονός ότι όταν το H2SO4 αντιδρά με PCl5, δύο ομάδες ΟΗ που υπάρχουν στο μόριο H2SO4 αντικαθίστανται από δύο άτομα Cl-. Ως αποτέλεσμα, λαμβάνεται σουλφουρυλοχλωρίδιο (Cl2SO2). Πολλές άλλες αντιδράσεις μπορούν να επιβεβαιώσουν την παρουσία δύο ομάδων ΟΗ απευθείας συνδεδεμένων με το άτομο S στη δομή του H2SO4.
Με βάση αυτά τα δεδομένα, υπάρχουν δύο δομές του H2SO4:η μία έχει δύο διπλούς δεσμούς και η άλλη έχει δύο δεσμούς συντεταγμένων.
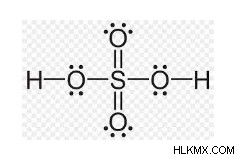
Υποτίθεται ότι αυτές οι δύο δομές του μορίου H2SO4 παραμένουν σε συντονισμό. Το θειικό οξύ έχει τετραεδρική δομή, στην οποία το θείο υβριδοποιείται sp³ με κατάσταση οξείδωσης +6.
Κατασκευή θειικού οξέος
Σήμερα, η παραγωγή θειικού οξέος χρησιμοποιεί δύο διαδικασίες. Αυτά είναι
1. Διαδικασία Lead Chamber:
Σε αυτή τη διαδικασία, σχηματίζεται θειικό οξύ όταν το μίγμα SO2, αέρα και ΝΟ υποβάλλεται σε επεξεργασία με ατμό (H2O). Σε αυτή τη διαδικασία, το ΝΟ δρα ως καταλύτης.
Η χημική αντίδραση λαμβάνει χώρα ως
2SO2 + O2 (από τον αέρα) + 2H2O + [NO] → 2H2SO4 + [NO]
2. Διαδικασία επικοινωνίας:
Αυτή η διαδικασία περιλαμβάνει τα ακόλουθα βήματα:
- Βήμα 1: Παρασκευή SO2.
S + O2 → SO2
- Βήμα 2: Οξείδωση SO2 σε SO3.
2SO2 + O2 ⇌ 2SO3
Αυτή η αντίδραση λαμβάνει χώρα παρουσία καταλύτη. Μπορεί να είναι Pt-αμίαντος, V2O5 ή Fe2O3.
- Βήμα 3: Διάλυση SO3 σε 98% H2SO4.
SO3 + H2SO4 → H2S2O7
- Βήμα 4: Αραίωση ελαίου με νερό.
H2S2O7 + H2O → 2H2SO4
Φυσικές ιδιότητες του θειικού οξέος
- Το καθαρό θειικό οξύ είναι ένα άχρωμο, πυκνό, βαρύ και σιροπιώδες ελαιώδες υγρό.
- Έχει πυκνότητα 1,84 στους 15℃, η οποία δεν ατμίζει.
- Το σημείο βρασμού του είναι 340℃ και οι άχρωμοι κρύσταλλοι του λιώνουν στους 10,38℃.
- Ο δεσμός Η μεταξύ μορίων θειικού οξέος δείχνει υψηλό σημείο βρασμού και ιξώδες.
- Είναι πολύ διαλυτό στο νερό. Και όταν προστίθεται νερό σε αυτό, παρουσιάζει μια εξαιρετικά εξώθερμη αντίδραση.
- Είναι ποιοτικός αγωγός ηλεκτρισμού και θερμότητας.
- Είναι εξαιρετικά διαβρωτικό σε ιστούς και μέταλλα. Ως εκ τούτου, το θειικό οξύ στο δέρμα προκαλεί εγκαύματα.
- Θα κάψει ξύλο και άλλες οργανικές ουσίες σε επαφή, αλλά δεν προκαλεί πυρκαγιά.
- Οι υψηλές συγκεντρώσεις θειικού οξέος μπορεί να έχουν σοβαρές επιπτώσεις στην υγεία από την εισπνοή.
Χημικές ιδιότητες του θειικού οξέος
1. Διάσπαση:
Το H2SO4, όταν θερμαίνεται, υφίσταται διάσταση σε ατμό (H2O) και SO3.
H2SO4 ⇌ H2O + SO3
2. Όξινη φύση:
Το υδατικό διάλυμα του οξέος συμπεριφέρεται ως ισχυρό διβασικό οξύ αφού ιονίζεται σε δύο στάδια και δίνει δύο ιόντα Η+. Για παράδειγμα,
H₂SO4 ⇌ 2H⁺ + SO4-
3. Οξειδωτικός παράγοντας:
Το θερμό συμπυκνωμένο θειικό οξύ δρα ως ισχυρός οξειδωτικός παράγοντας. Αυτό οφείλεται στο ότι το H2SO4 μπορεί να χάσει το εκκολαπτόμενο οξυγόνο αρκετά εύκολα. Όταν το H2SO4 οξειδώνει οποιαδήποτε ουσία, ανάγεται σε SO2. Αυτές οι οξειδωτικές ιδιότητες δεν είναι δυνατές με την αραίωση του H2SO4.
H2SO4 → H2O + SO2 + [O]
4. Αφυδατικός παράγοντας:
Το πυκνό H2SO4 διαλύεται σε νερό και σχηματίζει ένυδρες ενώσεις θειικού οξέος, H2SO4.nH2O. Λόγω αυτής της ιδιότητας, το συμπυκνωμένο H2SO4 εμφανίζει ιδιότητες αφυδάτωσης. Για παράδειγμα,
(COOH)2 + H2SO4 → CO + CO2 + [H2SO4.H2O]
5. Αντίδραση κατακρήμνισης:
Όταν τα υδατικά διαλύματα αλάτων ασβεστίου, βαρίου, μολύβδου κ.λπ. κατεργάζονται με αραιό H2SO4, σχηματίζονται λευκά ιζήματα των αντίστοιχων θειικών μετάλλων τους. Για παράδειγμα,
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
6. Ηλεκτρόλυση:
Όταν ηλεκτρόλυση 50% H2SO4, λαμβάνεται υπεροξυδισουλφουρικό οξύ (H2S2O8) στην άνοδο του διαλύματος.
7. Δράση στα άλατα:
Το H2SO4 είναι ένα ισχυρό οξύ που αποσυνθέτει τα άλατα περισσότερων πτητικών οξέων όπως ανθρακικά, θειώδη, νιτρικά, χλωριούχα κ.λπ. Το πιο πτητικό οξύ απελευθερώνεται σε κάθε περίπτωση. Για παράδειγμα,
2NaCl + H2SO4 → Na2SO4 + 2HCl
εξουδετερωτικό θειικό οξύ
Η διαδικασία εξουδετέρωσης του θειικού οξέος πρέπει να γίνεται με μεγάλη προσοχή και προφυλάξεις. Μπορείτε να ακολουθήσετε τα παρακάτω βήματα. Αυτά μπορούν να βοηθήσουν στην εξουδετέρωση του θειικού οξέος.
- Ρίξτε μαγειρική σόδα απευθείας στα σημεία όπου χύνεται το θειικό οξύ.
- Μην προσθέτετε νερό στις περιοχές με συμπυκνωμένο θειικό οξύ. Θα επιδεινώσει τις συνθήκες.
- Για να εξουδετερώσετε το θειικό οξύ, χρησιμοποιήστε ισχυρές βάσεις όπως το NaOH. Μην χρησιμοποιήσετε όμως το διάλυμά του, γιατί θα προκαλέσει μεγαλύτερη διαρροή.
- Στις περιοχές που έχουν χυθεί, ρίξτε αρκετό θρυμματισμένο πάγο.
- Αν χυθεί στα ρούχα σας, αφαιρέστε τα το συντομότερο δυνατό και πλύντε τα με τρεχούμενο νερό.
Χρήσεις για θειικό οξύ
Το θειικό οξύ χρησιμοποιείται στο σπίτι καθώς και σε βιομηχανίες για διάφορους σκοπούς. Λόγω των ποικίλων χρήσεων του θειικού οξέος, αποκαλείται συχνά ο «βασιλιάς των χημικών ουσιών». Μερικές από τις εμπορικές χρήσεις του θειικού οξέος είναι
- Χρησιμοποιείται για την παρασκευή διαφόρων λιπασμάτων όπως (NH4)2SO4, άμορφα, αμμωνιακά θειικά φωσφορικά, υπερφωσφορικά άλατα ασβέστη, K2SO4 κ.λπ.
- Παράγει άλλα οξέα όπως HCl, H3PO4, HNO3 κ.λπ.
- Χρησιμοποιείται στην κατασκευή εκρηκτικών όπως νιτρογλυκερίνη, τρινιτροτολουόλιο (TNT), πικρινικό οξύ, βαμβάκι όπλων, δυναμίτης κ.λπ.
- Το θειικό οξύ παρασκευάζει πολλές χημικές ουσίες όπως στυπτηρίες, θειικά μέταλλα, αιθέρες, φώσφορο, Na2CO3 κ.λπ.
- Χρησιμοποιείται στη διύλιση πετρελαίου.
- Χρησιμοποιείται σε πολλές μεταλλουργικές διεργασίες για τον καθαρισμό μετάλλων.
- Το θειικό οξύ βοηθά στην παραγωγή λιθανθρακόπισσας, βαφών και πολλών φαρμάκων και απολυμαντικών.
- Βοηθά στις βιομηχανίες κλωστοϋφαντουργίας, χαρτιού και βαφής.
- Βοηθά στη βιομηχανία δέρματος για το μαύρισμα.
- Χρησιμοποιείται για τον καθαρισμό μετάλλων πριν από την ηλεκτρολυτική επιμετάλλωση, την επισμάλτωση, τον γαλβανισμό κ.λπ.
- Χρησιμοποιείται σε μπαταρίες αποθήκευσης.
Χρήσεις θειικού οξέος στο σπίτι
Για εμπορικούς σκοπούς, το θειικό οξύ χρησιμοποιείται στο σπίτι. Μερικές από τις κοινές χρήσεις θειικού οξέος στο σπίτι είναι
- Βρίσκεται στις μπαταρίες των αυτοκινήτων.
- Χρησιμοποιείται σε ορισμένα καθαριστικά αποχέτευσης.
- Είναι ένα πρόσθετο σε σαπούνι χεριών πλυντηρίου σε σκόνη, απορρυπαντικά, προϊόντα για κατοικίδια και υγρό πιάτων.
- Βρίσκεται συνήθως σε προϊόντα καθαρισμού οικιακής χρήσης, όπως προϊόντα καθαρισμού αλουμινίου.
Συμπέρασμα
Το θειικό οξύ είναι το πιο κοινό οξύ. Χρησιμοποιείται σε μεγάλο βαθμό σε διάφορα χημικά πειράματα, βιομηχανίες και σπίτια. Χρησιμοποιείται για την παρασκευή διαφόρων ενώσεων που απαιτούνται σχεδόν από κάθε βιομηχανία. Είναι ένα ισχυρό ανόργανο οξύ.
Εάν χρησιμοποιηθεί με προσοχή, μπορεί να είναι ευεργετικό. Αλλά, χωρίς προφυλάξεις, μπορεί να είναι επιζήμιο για εσάς. Μπορεί να προκαλέσει σοβαρά προβλήματα υγείας ή ακόμα και να οδηγήσει σε θάνατο. Επομένως, συνιστάται η χρήση του με την κατάλληλη φροντίδα και προφυλάξεις και υπό την επίβλεψη ειδικών.
Συχνές ερωτήσεις
1. Ποιες είναι οι βλαβερές συνέπειες του θειικού οξέος;
- Μερικές από τις βλαβερές συνέπειες του θειικού οξέος είναι
- Το θειικό οξύ (H2SO4) είναι μια διαβρωτική ουσία που είναι καταστροφική για τα μάτια, το δέρμα, τους πνεύμονες και τα δόντια.
- Η οξεία έκθεση μπορεί να οδηγήσει σε θάνατο.
- Το συμπυκνωμένο H2SO4 μπορεί να πάρει φωτιά ή να εκραγεί όταν έρθει σε επαφή με πολλές χημικές ουσίες.
2. Όταν προστίθεται νερό στο θειικό οξύ, η διαδικασία γίνεται εξώθερμη. Γιατί;
Α. Όταν χύνεται νερό στο οξύ, παράγεται μεγάλη ποσότητα θερμότητας. Ως εκ τούτου, η θερμοκρασία ανεβαίνει στους 120℃. Η θερμότητα που παράγεται είναι τόσο μεγάλη που το οξύ εκτοξεύεται έξω από το δοχείο. Επομένως, εάν το οξύ είναι αραιωμένο, θα πρέπει να προστεθεί στο νερό αργά με συνεχή ανάδευση και όχι νερό στο οξύ.
3. Σε ποια μέρη κινδυνεύουν οι εργαζόμενοι να εκτεθούν στο θειικό οξύ;
Α. Μερικά από τα μέρη όπου οι εργαζόμενοι κινδυνεύουν είναι
- Μηχανικοί που σηκώνουν βρώμικες μπαταρίες.
- Εργαζόμενοι σε εξωτερικούς χώρους εργάζονται σε περιοχές όπου καίγεται πετρέλαιο, άνθρακας ή φυσικό αέριο.
- Εργαζόμενοι σε καταστήματα εκτυπώσεων, εκδόσεων ή φωτογραφιών.
- Εργολάβοι και υδραυλικοί που έχουν σχέση με καθαριστικά δοχείων τουαλέτας αναμεμειγμένα με νερό.
- Χαλυβουργοί και πυροσβέστες που εκτίθενται σε όξινη ομίχλη.
4. Τι προκαλεί το θειικό οξύ στο δέρμα;
Α. Οι επιδράσεις του θειικού οξέος στο δέρμα δίνονται παρακάτω:
- Μπορεί να προκαλέσει πόνο, εγκαύματα, ερυθρότητα και φουσκάλες.
- Μια μεγάλη ποσότητα θειικού οξέος στο δέρμα μπορεί να οδηγήσει σε μόνιμες ουλές.
- Μπορεί να προκαλέσει ακόμη και θάνατο εάν εκτεθεί σοβαρά.
- Μπορεί να προκαλέσει ξηρό, κόκκινο, σκασμένο δέρμα (δερματίτιδα) μετά από επαφή με το δέρμα.




