Ονομασία ιοντικών ενώσεων – Κανόνες ονοματολογίας
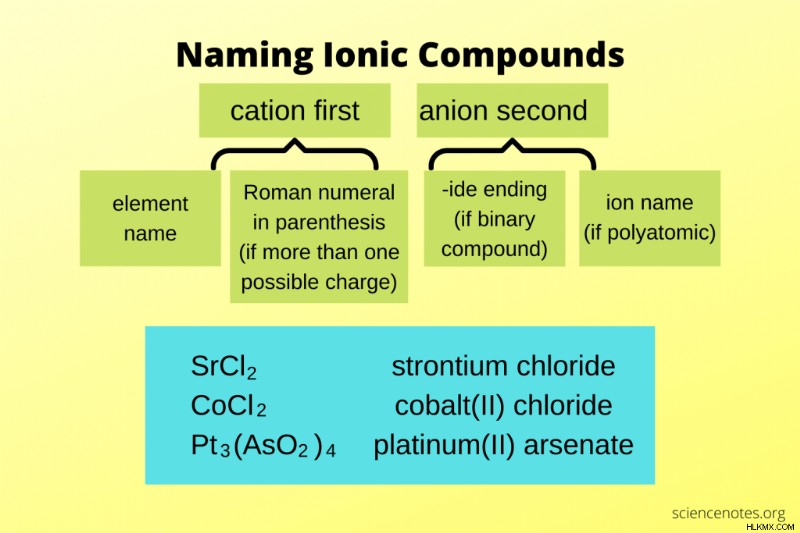
Οι κανόνες για την ονομασία ιοντικών ενώσεων είναι ένα απλό σύνολο οδηγιών που σας λένε πώς να μετατρέψετε έναν χημικό τύπο σε γραπτό όνομα ένωσης. Ακολουθεί η λίστα κανόνων μαζί με παραδείγματα ονομασίας δυαδικών και πολυατομικών ενώσεων. Η λίστα περιλαμβάνει μερικούς από τους ασυνήθιστους κανόνες και εξαιρέσεις που πρέπει να γνωρίζετε.
Κανόνες Ονομασίας Ιονικών Ενώσεων
- Πρώτον, ισορροπήστε τον χημικό τύπο για τη μάζα και το φορτίο. Μια ιοντική ένωση είναι ηλεκτρικά ουδέτερη. Με άλλα λόγια, τα θετικά ηλεκτρικά φορτία των κατιόντων εξισορροπούν ακριβώς τα αρνητικά ηλεκτρικά φορτία του ανιόντος.
- Γράψτε πρώτα το όνομα του στοιχείου του κατιόντος. Αυτό είναι σχεδόν πάντα ένα μέταλλο. Μια σημαντική εξαίρεση είναι το κατιόν αμμωνίου (NH4 ), το οποίο είναι ένα πολυατομικό κατιόν που αποτελείται από αμέταλλα. Σχηματίζει ιοντικές ενώσεις, όπως το χλωριούχο αμμώνιο (NH4 Cl).
- Εάν το κατιόν έχει περισσότερες από μία πιθανές καταστάσεις οξείδωσης (φόρτιση), ακολουθήστε το όνομα του στοιχείου σε παρένθεση που περιέχει τον κατάλληλο λατινικό αριθμό. Δεν υπάρχει κενό μεταξύ του ονόματος του στοιχείου και των παρενθέσεων. Τα στοιχεία στα οποία ισχύει αυτό είναι ορισμένα μέταλλα μετάπτωσης, συμπεριλαμβανομένων των λανθανιδών και των ακτινιδών. Για παράδειγμα, το κατιόν σιδήρου είναι είτε σίδηρος(II) είτε σίδηρος(III). Τα μέταλλα της ομάδας 1 (μέταλλα αλκαλίων) και της ομάδας 2 (μέταλλα αλκαλικών γαιών) έχουν πάντα το όνομα του στοιχείου τους, χωρίς ρωμαϊκούς αριθμούς.
- Σε αντίθεση με τα ονόματα των ομοιοπολικών ενώσεων, δεν υπάρχει πρόθεμα που να δείχνει τον αριθμό των ατόμων στο κατιόν. Άρα, Hg2 Cl2 είναι χλωριούχος υδράργυρος(II) και όχι διχλωριούχος διυδράργυρος(II). Η εξαίρεση είναι όταν υποδεικνύετε σχετική σύνθεση. Λοιπόν, K2 MgCl4 είναι τετραχλωριούχο δικάλιο μαγνήσιο, που το διακρίνει από το KMgCl3 , που είναι τριχλωριούχο μαγνήσιο κάλιο.
- Εάν υπάρχουν πολλά άτομα μετάλλου στον τύπο, ο τύπος και το όνομα παραθέτουν τα στοιχεία με αλφαβητική σειρά. Μερικές φορές αυτή η σειρά είναι διαφορετική για τον τύπο και το όνομα. Έτσι, KMgCl3 είναι τριχλωριούχο μαγνήσιο κάλιο και όχι τριχλωριούχο κάλιο μαγνήσιο.
- Το όνομα ανιόντος ακολουθεί το κατιόν. Ένα κενό χωρίζει τα δύο μέρη του ονόματος της ιοντικής ένωσης. Εάν η ένωση είναι μια δυαδική ένωση ή το ανιόν είναι ένας απλός τύπος ατόμου, το όνομα ανιόντος είναι ένας συνδυασμός του ονόματος του στοιχείου με την κατάληξη -ide. Για παράδειγμα, το AgCl έχει το όνομα χλωριούχος αργύρου.
- Εάν το ανιόν αποτελείται από πολλούς τύπους ατόμων, χρησιμοποιήστε το όνομα πολυατομικού ιόντος.
Παραδείγματα ονομάτων και τύπων ιοντικών ενώσεων
Ακολουθούν παραδείγματα δυαδικών χημικών τύπων και ονομάτων:
| Τύπος | Συστηματικό όνομα |
|---|---|
| SrCl2 | χλωριούχο στρόντιο |
| CuCl | χλωριούχος χαλκός(I) |
| CuCl2 | χλωριούχος χαλκός(II) |
| Mg(OH)2 | υδροξείδιο μαγνησίου |
| Pt3 (AsO2 )4 | αρσενικό πλατίνα(II) |
Κλασικό Σύστημα Ονομασίας Ιονικών Ενώσεων
Όταν διαβάζετε παλαιότερα κείμενα και άρθρα, θα δείτε τα κλασικά ονόματα των ιοντικών ενώσεων. Οι κανόνες για την ονομασία ανιόντων είναι οι ίδιοι. Όμως, αντί να χρησιμοποιούνται λατινικοί αριθμοί, τα ονόματα κατιόντων αντικατοπτρίζουν την κατάσταση οξείδωσης μετάλλου χρησιμοποιώντας τις καταλήξεις -ous (μικρότερο φορτίο) ή -ic (μεγαλύτερο φορτίο).
- Fe – σιδηρούχο
- Fe – σίδηρος
- Cu – χαλκού
- Cu – χαλκός
- Sn – stannic
- Sn – κασσίτερος
- Pb – υδραυλικό
- Pb – υδραυλικό
- Cr – χρωματικό
- Cr – χρωμικό
- Au – aurous
- Au – auric
Η αντικατάσταση αυτού του συστήματος με το παρόν αποφεύγει την περιττή σύγχυση και επιτρέπει περισσότερες από δύο καταστάσεις οξείδωσης. Για παράδειγμα, το παλιό σύστημα δεν κάλυπτε την ονομασία της κατάστασης οξείδωσης Cr (εξασθενές χρώμιο).
Φύλλο εργασίας ονομασίας ιοντικής ένωσης
Εξασκηθείτε στην ονομασία ιοντικών ενώσεων. Αυτό το φύλλο εργασίας ελέγχει την ικανότητά σας να δίνετε ονόματα και τύπους. Το φύλλο εργασίας και το κλειδί απάντησης είναι σε μορφή PDF για εύκολη λήψη και εκτύπωση.
[Φύλλο εργασίας PDF] [Κλειδί απάντησης]
Αναφορές
- Fernelius, W. Conard (Νοέμβριος 1982). «Αριθμοί σε χημικές ονομασίες». Journal of Chemical Education . 59 (11):964. doi:10.1021/ed059p964
- International Union of Pure and Applied Chemistry, Division of Chemical Nomenclature (2005). Neil G. Connelly (επιμ.). Ονοματολογία Ανόργανης Χημείας:Συστάσεις IUPAC 2005 (Νέα έκδοση). Cambridge:RSC Publ. ISBN 978-0-85404-438-2.
- Kotz, John C.; Treichel, Paul M; Weaver, Gabriela C. (2006). Χημεία και Χημική Αντιδραστικότητα (6η έκδ.). Μπέλμοντ, Καλιφόρνια:Τόμσον Μπρουκς/Κόουλ. ISBN 978-0-534-99766-3.
- Zumdahl, Steven S. (1989). Χημεία (2η έκδ.). Λέξινγκτον, Μασαχουσέτη:D.C. Heath. ISBN 978-0-669-16708-5.




