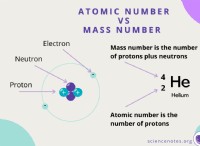
Τι δεσμεύματα στοιχεία;
Ακολουθεί μια ανάλυση των κύριων τύπων συγκόλλησης:
1. Ιοντικός δεσμός
* εμφανίζεται μεταξύ: Μέταλλα και μη μέταλλα.
* Πώς λειτουργεί: Τα μέταλλα τείνουν να χάνουν ηλεκτρόνια για να γίνουν θετικά φορτισμένα ιόντα (κατιόντα), ενώ τα μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να γίνουν αρνητικά φορτισμένα ιόντα (ανιόντα). Η ηλεκτροστατική έλξη μεταξύ των αντιθέτων ιόντων τους κρατά μαζί.
* Παραδείγματα: Χλωριούχο νάτριο (NaCl), βρωμίδιο καλίου (KBR), οξείδιο μαγνησίου (MGO)
2. Ομοιοπολική σύνδεση
* εμφανίζεται μεταξύ: Αμέταλλα.
* Πώς λειτουργεί: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων. Τα κοινόχρηστα ηλεκτρόνια προσελκύονται από τους πυρήνες και των δύο ατόμων, σχηματίζοντας έναν ισχυρό δεσμό.
* Τύποι ομοιοπολικών δεσμών:
* μη πολική ομοιοπολική: Ίση κατανομή των ηλεκτρονίων μεταξύ ατόμων του ίδιου στοιχείου. (π.χ., H2, CL2, O2)
* Polar Covalent: Η μη εξουσιοδότηση των ηλεκτρονίων μεταξύ ατόμων διαφορετικών στοιχείων λόγω διαφορών ηλεκτροαρνητικότητας. (π.χ., H2O, CO2, NH3)
* Παραδείγματα: Νερό (H2O), μεθάνιο (CH4), διοξείδιο του άνθρακα (CO2)
3. Μεταλλικός δεσμός
* εμφανίζεται μεταξύ: Μέταλλα.
* Πώς λειτουργεί: Τα άτομα μετάλλων συνεισφέρουν τα ηλεκτρόνια σθένους τους σε μια "θάλασσα" από απομακρυσμένα ηλεκτρόνια που κινούνται ελεύθερα σε όλη τη μεταλλική δομή. Αυτή η "θάλασσα" των ηλεκτρονίων συγκρατεί τα μεταλλικά ιόντα μαζί.
* Παραδείγματα: Χαλκός (Cu), Σίδηρος (Fe), Χρυσός (AU)
Άλλοι τύποι σύνδεσης
* δεσμός υδρογόνου: Ένας ειδικός τύπος διαμοριακής έλξης που συμβαίνει μεταξύ των μορίων που περιέχουν υδρογόνο που συνδέονται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο, το άζωτο ή η φθορίνη).
* Van der Waals Δυνάμεις: Αδύνατα αξιοθέατα που προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων μέσα σε μόρια.
Σημαντικές σημειώσεις:
* Διαφορές ηλεκτροαρνητικότητας Προσδιορίστε τον τύπο του δεσμού. Μεγαλύτερες διαφορές ευνοούν την ιοντική συγκόλληση, ενώ οι μικρότερες διαφορές ευνοούν την ομοιοπολική συγκόλληση.
* Τα στοιχεία μπορούν να συνδεθούν με πολλά άλλα στοιχεία για να σχηματίσουν σύνθετες ενώσεις.
* Ο τύπος σύνδεσης επηρεάζει έντονα τις ιδιότητες μιας ένωσης. Για παράδειγμα, οι ιοντικές ενώσεις τείνουν να είναι εύθραυστες και έχουν υψηλά σημεία τήξης, ενώ οι ομοιοπολικές ενώσεις είναι συχνά μαλακές και έχουν χαμηλά σημεία τήξης.
Επιτρέψτε μου να ξέρω αν θέλετε περισσότερες λεπτομέρειες σχετικά με οποιοδήποτε συγκεκριμένο τύπο σύνδεσης!