Τι είναι ένας ατομικός αριθμός; Ορισμός και Παραδείγματα

Ο ατομικός αριθμός είναι ο αριθμός των πρωτονίων που βρίσκονται στον πυρήνα ενός ατόμου, ο οποίος προσδιορίζει μοναδικά το στοιχείο του. Ο ατομικός αριθμός ονομάζεται επίσης αριθμός πρωτονίων. Συμβολίζεται με το σύμβολο Z και είναι ο δείκτης στον ατομικό συμβολισμό. Το σύμβολο Z προέρχεται από τη γερμανική λέξη zahl , που σημαίνει αριθμητικό ή atomzahl , που σημαίνει ατομικός αριθμός.
Επειδή τα νετρόνια είναι ουδέτερα, ο ατομικός αριθμός ισούται με το ηλεκτρικό φορτίο του ατομικού πυρήνα. Σε ένα ουδέτερο άτομο, ο ατομικός αριθμός είναι ίσος με τον αριθμό των ηλεκτρονίων.
Σημασία του ατομικού αριθμού
Ο ατομικός αριθμός είναι σημαντικός γιατί προσδιορίζει το στοιχείο. Επίσης, ο περιοδικός πίνακας είναι διατεταγμένος κατά σειρά αυξανόμενου ατομικού αριθμού. Ο ατομικός αριθμός καθορίζει τις ιδιότητες ενός στοιχείου επειδή είναι ο αριθμός των ηλεκτρονίων σε ένα ουδέτερο άτομο. Αυτό καθορίζει τη διαμόρφωση ηλεκτρονίων του ατόμου και τη φύση του κελύφους ηλεκτρονίων σθένους. Τα ηλεκτρόνια σθένους καθορίζουν πόσο εύκολα ένα άτομο σχηματίζει χημικούς δεσμούς και τον τύπο των δεσμών που σχηματίζει.
Λίστα ατομικών αριθμών
Οι ατομικοί αριθμοί είναι πάντα ακέραιοι θετικοί αριθμοί. Όλα τα άτομα με ατομικό αριθμό 1 είναι άτομα υδρογόνου. όλα τα άτομα με ατομικό αριθμό 118 είναι άτομα oganesson. Ο αριθμός των νετρονίων και των ηλεκτρονίων δεν επηρεάζει την ταυτότητα ενός ατόμου, μόνο το ισότοπο και το ηλεκτρικό του φορτίο, αντίστοιχα. Ο περιοδικός πίνακας έχει αυτή τη στιγμή 118 ατομικούς αριθμούς. Όταν ανακαλυφθεί ένα νέο στοιχείο, ο ατομικός του αριθμός θα είναι ο αριθμός των πρωτονίων στον ατομικό του πυρήνα.
| ΑΤΟΜΙΚΟΣ ΑΡΙΘΜΟΣ | ΣΥΜΒΟΛΟ | ΣΤΟΙΧΕΙΟ |
| 1 | H | Υδρογόνο |
| 2 | Αυτός | Ήλιο |
| 3 | Li | Λίθιο |
| 4 | Be | Βηρύλλιο |
| 5 | Β | Βόριο |
| 6 | Γ | Άνθρακας |
| 7 | Μ | Άζωτο |
| 8 | O | Οξυγόνο |
| 9 | F | Φθόριο |
| 10 | Όχι | Νέον |
| 11 | Όχι | Νάτριο |
| 12 | Mg | Μαγνήσιο |
| 13 | Al | Αλουμίνιο |
| 14 | Si | Πυρίτιο |
| 15 | P | Φώσφορος |
| 16 | S | Θείο |
| 17 | Κλ | Χλώριο |
| 18 | Ar | Αργόν |
| 19 | K | Κάλιο |
| 20 | Περίπου | Ασβέστιο |
| 21 | Sc | Σκάνδιο |
| 22 | Τι | Τιτάνιο |
| 23 | V | Βανάδιο |
| 24 | Cr | Chromium |
| 25 | Mn | Μαγγάνιο |
| 26 | Φε | Σίδερο |
| 27 | Συν | Κοβάλτιο |
| 28 | Ni | Νίκελ |
| 29 | Cu | Χαλκός |
| 30 | Zn | Ψευδάργυρος |
| 31 | Γα | Γάλλιο |
| 32 | Ge | Γερμάνιο |
| 33 | Όπως | Αρσενικό |
| 34 | Δείτε | Σελήνιο |
| 35 | Br | Βρώμιο |
| 36 | Kr | Krypton |
| 37 | Rb | Ρουβίδιο |
| 38 | Sr | Στρόντιο |
| 39 | Ε | Ύττριο |
| 40 | Zr | Ζιρκόνιο |
| 41 | Σημ. | Νιόβιο |
| 42 | Mo | Μολυβδαίνιο |
| 43 | Tc | Τεχνήτιο |
| 44 | Ru | Ρουθήνιο |
| 45 | Rh | Ρόδιο |
| 46 | Pd | Παλλάδιο |
| 47 | Ag | Ασημί |
| 48 | Cd | Κάδμιο |
| 49 | Σε | Ίνδιο |
| 50 | Sn | Κασσίτερος |
| 51 | Sb | Αντιμόνιο |
| 52 | Σε | Τελλούριο |
| 53 | I | Ιώδιο |
| 54 | Xe | Xenon |
| 55 | Cs | Κάσιο |
| 56 | Ba | Βάριο |
| 57 | La | Λανθάνιο |
| 58 | Ε | Cerium |
| 59 | Pr | Πρασεοδύμιο |
| 60 | Δ | Νεοδύμιο |
| 61 | ΜΜ | Προμέθιο |
| 62 | Sm | Σαμάριο |
| 63 | Ευ | Ευρώπιο |
| 64 | Gd | Γαδολίνιο |
| 65 | Tb | Τέρβιο |
| 66 | Dy | Δυσπρόσιο |
| 67 | Ho | Χόλμιο |
| 68 | Ε | Έρβιο |
| 69 | Tm | Θούλιο |
| 70 | Yb | Υτέρβιο |
| 71 | Λου | Λουτέτιο |
| 72 | Hf | Hafnium |
| 73 | Τα | Ταντάλιο |
| 74 | W | Βολφράμιο |
| 75 | Re | Ρήνιο |
| 76 | Λειτουργία | Όσμιο |
| 77 | I | Ιρίδιο |
| 78 | Pt | Πλατινένιο |
| 79 | Au | Χρυσός |
| 80 | Hg | Ερμής |
| 81 | Tl | Θάλλιο |
| 82 | Pb | Προηγούμενος |
| 83 | Bi | Βισμούθιο |
| 84 | Po | Πολώνιο |
| 85 | Σε | Αστατίνη |
| 86 | Rn | Ραδόνιο |
| 87 | Fr | Φράγκιο |
| 88 | Ra | Ράδιο |
| 89 | Ac | Ακτίνιο |
| 90 | Θ | Θόριο |
| 91 | Πα | Πρωτακτίνιο |
| 92 | U | Ουράνιο |
| 93 | Np | Ποσειδώνιο |
| 94 | Pu | Πλουτώνιο |
| 95 | Π.μ. | Americium |
| 96 | cm | Κούριο |
| 97 | Bk | Βερκέλιο |
| 98 | Πρ | Καλιφόρνιο |
| 99 | Es | Αϊνστάιν |
| 100 | Fm | Φέρμιο |
| 101 | Md | Μεντελέβιο |
| 102 | Όχι | Nobelium |
| 103 | Lr | Λαυρένιο |
| 104 | Rf | Rutherfordium |
| 105 | Db | Dubnium |
| 106 | Sg | Seaborgium |
| 107 | Bh | Βόριο |
| 108 | Υ | Χάσιο |
| 109 | Mt | Meitnerium |
| 110 | Δ | Darmstadtium |
| 111 | Rg | Roentgenium |
| 112 | Cn | Κοπερνίκιο |
| 113 | Νη | Νιχόνιο |
| 114 | Fl | Flerovium |
| 115 | Mc | Μοσκόβιο |
| 116 | Lv | Livermorium |
| 117 | Ts | Τενεσί |
| 118 | Og | Oganesson |
Ατομικός αριθμός έναντι μαζικού αριθμού
Ενώ ο ατομικός αριθμός είναι ο αριθμός των πρωτονίων σε ένα άτομο, ο μαζικός αριθμός είναι το άθροισμα του αριθμού των πρωτονίων και των νετρονίων (τα νουκλεόνια). Το σύμβολο για τον μαζικό αριθμό είναι το Α, το οποίο προέρχεται από τη γερμανική λέξη Atomgewcht (ατομικό βάρος).
Ο μαζικός αριθμός προσδιορίζει το ισότοπο ενός στοιχείου. Τα ισότοπα ενός στοιχείου έχουν τον ίδιο ατομικό αριθμό, αλλά διαφορετικούς μαζικούς αριθμούς. Ο μαζικός αριθμός μπορεί να γραφτεί μετά από ένα όνομα στοιχείου ή σύμβολο (π.χ. carbon-14) ή ως εκθέτης πάνω ή στα αριστερά ενός συμβόλου στοιχείου (π.χ., C). Ένα πλήρες σύμβολο ισοτόπου (μορφή A/Z) περιλαμβάνει τόσο την ατομική μάζα όσο και τον ατομικό αριθμό (π.χ. 6 Γ, 6 Γ).
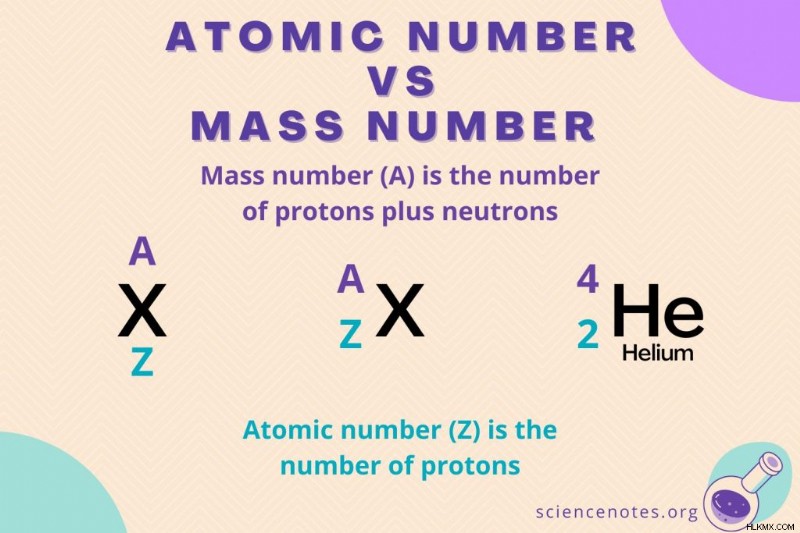
Ο μαζικός αριθμός δεν περιλαμβάνει τη μάζα των ηλεκτρονίων επειδή είναι αμελητέα σε σύγκριση με τη μάζα των πρωτονίων ή των νετρονίων. Τα πρωτόνια και τα νετρόνια ζυγίζουν το καθένα περίπου μία μονάδα ατομικής μάζας (amu), ενώ η μάζα ενός ηλεκτρονίου είναι μόνο 0,000549 amu.
Πώς να βρείτε τον ατομικό αριθμό
Ο τρόπος με τον οποίο βρίσκετε τον ατομικό αριθμό ενός στοιχείου εξαρτάται από τις πληροφορίες που σας δίνονται.
- Εάν γνωρίζετε το όνομα ή το σύμβολο του στοιχείου, μπορείτε να αναζητήσετε τον ατομικό αριθμό σε οποιονδήποτε περιοδικό πίνακα. (Η εξαίρεση είναι ο περιοδικός πίνακας του Mendeleev, ο οποίος τακτοποίησε τα στοιχεία κατά ατομικό βάρος αντί για ατομικό αριθμό.) Μπορεί να υπάρχουν πολλοί αριθμοί που σχετίζονται με κάθε στοιχείο, αλλά ο ατομικός αριθμός είναι πάντα ένας θετικός ακέραιος αριθμός.
- Βρείτε τον ατομικό αριθμό από το σύμβολο του ισοτόπου με τον ίδιο τρόπο. Για παράδειγμα, εάν το σύμβολο είναι C, γνωρίζετε ότι το σύμβολο του στοιχείου είναι C. Αναζητήστε το σύμβολο "C" στον περιοδικό πίνακα για να λάβετε τον ατομικό αριθμό.
- Συνήθως, τόσο ο μαζικός αριθμός όσο και ο ατομικός αριθμός δίνονται σε ένα σύμβολο ισοτόπου. Για παράδειγμα, εάν το σύμβολο είναι 6 C, αναγράφεται ο αριθμός "6". Ο ατομικός αριθμός είναι ο μικρότερος από τους δύο αριθμούς του συμβόλου. Συνήθως βρίσκεται ως δείκτης στα αριστερά του συμβόλου του στοιχείου.
Αναφορές
- IUPAC (1997). «Ατομικός αριθμός (αριθμός πρωτονίου) Z». Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). Επιστημονικές Εκδόσεις Blackwell:Οξφόρδη. doi:10.1351/goldbook
- Jensen, William B. (2005). «Η προέλευση των συμβόλων Α και Ω για το ατομικό βάρος και τον αριθμό». J. Chem. Εκπαίδευση. 82:1764.
- Scerri, Eric (2013). A Tale of Seven Elements . Oxford University Press. ISBN 978-0-19-539131-2.




