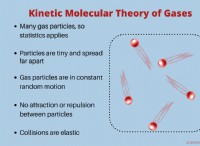
Ποιες είναι οι παρόμοιες χημικές ιδιότητες που αποδίδονται;
* ηλεκτρόνια σθένους: Αυτά είναι τα ηλεκτρόνια στο εξωτερικό κέλυφος ενός ατόμου. Είναι αυτοί που εμπλέκονται στη χημική σύνδεση, καθορίζοντας τον τρόπο με τον οποίο ένα στοιχείο αλληλεπιδρά με άλλα στοιχεία.
* Διαμόρφωση ηλεκτρονίων: Η κατανομή των ηλεκτρόνων σε επίπεδα ενέργειας και τα στελέχη μέσα σε ένα άτομο. Στοιχεία με παρόμοιες διαμορφώσεις ηλεκτρονίων, ιδιαίτερα στα κελύφη σθένους τους, παρουσιάζουν παρόμοια χημική συμπεριφορά.
Εδώ είναι οι παρόμοιες διαμορφώσεις ηλεκτρονίων οδηγούν σε παρόμοιες ιδιότητες:
* Παρόμοια αντιδραστικότητα: Τα στοιχεία με τον ίδιο αριθμό ηλεκτρονίων σθένους τείνουν να σχηματίζουν παρόμοιους τύπους δεσμών και συμμετέχουν σε παρόμοιες χημικές αντιδράσεις. Για παράδειγμα, όλα τα αλκαλικά μέταλλα (Li, Na, K, Rb, Cs, Fr) έχουν ένα ηλεκτρόνιο σθένους, καθιστώντας τους ιδιαίτερα αντιδραστικοί και επιρρεπείς στην απώλεια αυτού του ηλεκτρόνου για να σχηματίσουν ένα ιόν +1.
* Παρόμοια πρότυπα συγκόλλησης: Τα στοιχεία με παρόμοιες διαμορφώσεις ηλεκτρονίων σθένους τείνουν να σχηματίζουν τους ίδιους τύπους δεσμών (ιοντικά, ομοιοπολικά, μεταλλικά). Για παράδειγμα, τα αλογόνα (F, CL, BR, I, AT) έχουν όλα επτά ηλεκτρόνια σθένους και εύκολα κερδίζουν ένα ηλεκτρόνιο για να σχηματίσουν ένα ιόν -1.
* Παρόμοιες καταστάσεις οξείδωσης: Τα στοιχεία με παρόμοιες διαμορφώσεις ηλεκτρονίων συχνά παρουσιάζουν παρόμοιες καταστάσεις οξείδωσης, αντανακλώντας την τάση τους να κερδίζουν ή να χάνουν ηλεκτρόνια. Για παράδειγμα, τα μεταβατικά μέταλλα στην ίδια ομάδα τείνουν να παρουσιάζουν παρόμοιες καταστάσεις οξείδωσης λόγω των παρόμοιων διαμορφώσεων D-ηλεκτρονίων τους.
Είναι σημαντικό να σημειώσετε:
* Περιοδικές τάσεις: Ο περιοδικός πίνακας οργανώνει στοιχεία που βασίζονται στις διαμορφώσεις ηλεκτρονίων τους και παρατηρούνται παρόμοιες χημικές ιδιότητες εντός ομάδων (στήλες) και περιόδους (σειρές). Αυτό μας επιτρέπει να προβλέψουμε τις ιδιότητες των στοιχείων με βάση τη θέση τους στον πίνακα.
* Εξαιρέσεις: Ενώ η διαμόρφωση ηλεκτρονίων είναι ένας πρωταρχικός παράγοντας, υπάρχουν κάποιες εξαιρέσεις. Παράγοντες όπως το μέγεθος του ατόμου, η ηλεκτροαρνητικότητα και το πυρηνικό φορτίο μπορούν επίσης να επηρεάσουν τη χημική συμπεριφορά.
Συμπερασματικά, παρόμοιες διαμορφώσεις ηλεκτρονίων, ειδικά στο κέλυφος σθένους, είναι ο κύριος λόγος για τον οποίο τα στοιχεία παρουσιάζουν παρόμοιες χημικές ιδιότητες. Αυτή η κατανόηση είναι θεμελιώδης για την κατανόηση της χημικής αντιδραστικότητας, της σύνδεσης και της συμπεριφοράς των στοιχείων σε διάφορες αντιδράσεις και ενώσεις.