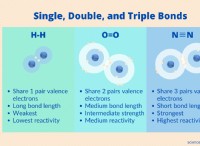
Τι είδους δεσμός σχηματίζεται μεταξύ φωσφόρου και ιωδίου;
Εδώ είναι γιατί:
* Ηλεκτροργατιστικότητα: Ο φωσφόρος και το ιώδιο έχουν σχετικά παρόμοιες ηλεκτροθετικές ικανότητες. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του σε χημικό δεσμό. Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ φωσφόρου και ιωδίου δεν είναι αρκετά μεγάλη για να δημιουργήσει ένα ιοντικό δεσμό.
* Κοινή χρήση ηλεκτρονίων: Δεδομένου ότι έχουν παρόμοια ηλεκτροαρνητικότητα, τα ηλεκτρόνια φωσφόρου και ιωδίου για να επιτύχουν σταθερή διαμόρφωση ηλεκτρονίων. Αυτή η κοινή χρήση ηλεκτρονίων είναι το καθοριστικό χαρακτηριστικό ενός ομοιοπολικού δεσμού.
Επομένως, ο δεσμός στο ιωδιούχο φωσφόρου (PI3) είναι ομοιοπολικός.