Πώς υπολογίζετε τις μάζες των χημικών αντιδραστηρίων και των προϊόντων σε μια αντίδραση;
1. Η ισορροπημένη χημική εξίσωση
* Ξεκινήστε με μια ισορροπημένη χημική εξίσωση. Αυτή η εξίσωση δείχνει την ακριβή αναλογία μορίων (ή moles) που εμπλέκονται στην αντίδραση.
* Παράδειγμα:
2 h₂ + o₂ → 2 h₂o
Αυτή η εξίσωση μας λέει:2 γραμμομονείς αερίου υδρογόνου (H₂) αντιδρούν με 1 mole αερίου οξυγόνου (O₂) για να παράγουν 2 moles νερού (H₂O).
2. Moles και μοριακή μάζα
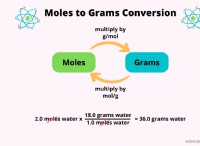
* moles: Το mole είναι η μονάδα SI για την ποσότητα της ουσίας. Ένα mole περιέχει 6.022 x 10²³ σωματίδια (άτομα, μόρια, κλπ.).
* Μοριακή μάζα: Η γραμμομοριακή μάζα μιας ουσίας είναι η μάζα ενός γραμμομόρου αυτής της ουσίας. Συνήθως εκφράζεται σε γραμμάρια ανά mole (g/mol). Μπορείτε να βρείτε μοριακές μάζες στον περιοδικό πίνακα.
3. Υπολογισμός μάζες
Βήμα 1:Μετατρέψτε τις γνωστές ποσότητες σε moles
* Εάν δοθεί η μάζα ενός αντιδραστηρίου ή προϊόντος: Διαχωρίστε τη δεδομένη μάζα από τη μοριακή μάζα αυτής της ουσίας για να αποκτήσετε τον αριθμό των γραμμομορίων.
Βήμα 2:Χρησιμοποιήστε την αναλογία mole από την ισορροπημένη εξίσωση
* Οι συντελεστές στην ισορροπημένη εξίσωση αντιπροσωπεύουν την αναλογία mole. Για παράδειγμα, στην παραπάνω εξίσωση, η αναλογία mole του H₂ προς H₂O είναι 2:2 (ή απλοποιημένη, 1:1).
* Υπολογίστε τις γραμμομορείς της επιθυμητής ουσίας χρησιμοποιώντας την αναλογία mole. Εάν γνωρίζετε τα κομμάτια μιας ουσίας, μπορείτε να βρείτε τα κομμάτια μιας άλλης ουσίας που εμπλέκεται στην αντίδραση.
Βήμα 3:Μετατρέψτε τα moles πίσω στη μάζα
* Πολλαπλασιάστε τον αριθμό των γραμμομορίων της επιθυμητής ουσίας με τη μοριακή μάζα για να βρει τη μάζα του σε γραμμάρια.
Παράδειγμα:
Πρόβλημα: Πόσα γραμμάρια νερού (H₂O) παράγονται όταν 10 γραμμάρια αερίου υδρογόνου (H₂) αντιδρούν εντελώς με οξυγόνο;
Λύση:
1. Μοριακές μάζες:
* H₂ =2.016 g/mol
* O₂ =32.00 g/mol
* H₂o =18.015 g/mol
2. moles του h₂:
* 10 g h₂ / 2.016 g / mol =4.96 mol h₂
3. moles του h₂o:
* Από την ισορροπημένη εξίσωση, 2 mol H₂ =2 mol H₂O, έτσι έχουμε παραχθεί 4,96 mol h₂o.
4. Μάζα H₂o:
* 4.96 mol h₂o * 18.015 g/mol =89.34 g h₂o
Σημαντικές εκτιμήσεις
* Περιορισμός αντιδραστηρίου: Σε πολλές αντιδράσεις, ένα αντιδραστήριο θα εξαντληθεί εντελώς πριν από το άλλο. Αυτό είναι το περιοριστικό αντιδραστήριο και καθορίζει τη μέγιστη ποσότητα προϊόντος που μπορεί να σχηματιστεί.
* Ποσοστό απόδοσης: Η θεωρητική απόδοση είναι η μέγιστη ποσότητα προϊόντος που μπορεί να σχηματιστεί με βάση την στοιχειομετρία. Η πραγματική απόδοση είναι η ποσότητα του προϊόντος που πραγματικά λαμβάνεται στο πείραμα. Η ποσοστιαία απόδοση υπολογίζεται ως (πραγματική απόδοση / θεωρητική απόδοση) * 100%.
* πλευρικές αντιδράσεις: Ορισμένες αντιδράσεις παράγουν ανεπιθύμητα υποπροϊόντα, τα οποία μπορούν να επηρεάσουν την απόδοση του επιθυμητού προϊόντος.
Επιτρέψτε μου να ξέρω αν έχετε μια συγκεκριμένη αντίδραση που θέλετε να εργαστείτε!