BCl3 Μοριακή Γεωμετρία και Γωνίες Δεσμών
Το
sp² είναι το είδος υβριδισμού που εμφανίζεται στο BCl3. Το βόριο σε BCl3 αποφασίζεται ως κεντρικό άτομο με τρία ηλεκτρόνια με δεσμό, αλλά δεν περιλαμβάνει ένα ζεύγος ηλεκτρονίων. Συνεχίστε να διαβάζετε για να κατανοήσετε περαιτέρω τον υβριδισμό των BCl3, BCl3 Lewis Structure, BCl3 Bond Angles, BCl3 Molecular Figure and Bond Angles, κ.λπ.
Πώς να ορίσετε απλά την Υβριδοποίηση;
Το 1931, ο επιστήμονας Linus Carl Pauling, ένας Αμερικανός χημικός, παρουσίασε την επαναστατική θεωρία του υβριδισμού. Όρισε τον υβριδισμό ως την ανακατανομή της ενέργειας συγκεκριμένων τροχιακών ατόμων για την παραγωγή νέων τροχιακών ίσης ενέργειας..
Συνδύασαν δύο ατομικά τροχιακά για να σχηματίσουν έναν νέο τύπο υβριδοποιημένων τροχιακών, που ονομάζεται υβριδισμός. Τυπικά, αυτή η ανάμειξη έχει ως αποτέλεσμα την ανάπτυξη υβριδικών τροχιακών με θεμελιωδώς διαφορετικές ενέργειες, σχήματα κ.λπ. Τα ατομικά τροχιακά του ίδιου ενεργειακού επιπέδου ευθύνονται κυρίως για τον υβριδισμό. Ωστόσο, εάν οι ενέργειές τους είναι ισοδύναμες, μπορούν να συμμετέχουν τόσο τα γεμάτα όσο και τα μισογεμάτα τροχιακά. Η αρχή του υβριδισμού είναι μια επέκταση της θεωρίας του δεσμού σθένους που μας βοηθά να κατανοήσουμε τον σχηματισμό δεσμών, την ενέργεια των δεσμών και τα μήκη των δεσμών.
Τα απειροελάχιστα τροχιακά ανάλογης ενέργειας αναμειγνύονται κατά τη διάρκεια της μεθόδου υβριδισμού παρόμοια λόγω της ανάμειξης του τροχιακού 2s του τροχιακού 2p ή της ανάμειξης του s-τροχιακού με του τροχιακού p με το τροχιακό.
Πολικότητα BCl3
Το BCl3 είναι ένα μη πολικό μόριο. Ένας πολικός δεσμός απαιτεί μια ασύμμετρη μετατόπιση σχήματος στην πυκνότητα ηλεκτρονίων για να δημιουργήσει ένα ηλεκτρικό δίπολο, το οποίο δεν έχει το BCl3. Το χημικό μόριο BCl3 έχει τύπο υβριδισμού sp².
Επομένως, δεν υπάρχει πόλωση των φορτίων σε όλη την ενημερωμένη έκδοση κώδικα BCl3. Για περισσότερες πληροφορίες, πρέπει επίσης να περάσετε από μια σύνθεση σχετικά με την αντίθεση του BCl3.
Μοριακή γεωμετρία και γωνίες δεσμού τριχλωριούχου βορίου
Ο υβριδισμός σε τριχλωριούχο βόριο είναι υβριδισμός sp2. Αυτό εξηγεί την ικανότητα του βορίου να συνδέεται με τρία άλλα άτομα και όταν μια τροχιά δεν είναι γεμάτη, είναι έτοιμο να σχηματίσει δεσμό.
υβριδισμός sp2 Όταν ένα s και δύο p τροχιακά ενός θραύσματος αναμειγνύονται για να σχηματίσουν τρία αρχικά τροχιακά, αυτή η μέθοδος ονομάζεται υβριδισμός sp2. Οι τρεις τροχιές που δημιουργούνται με υβριδισμό sp2 σε ένα επίπεδο είναι 1200 μεταξύ τους.
Το μοτίβο βασικής κατάστασης είναι 1s2 2s2 2p1. Έχει μόνο ένα ασύζευκτο ηλεκτρόνιο. Δεδομένου ότι χρειάζονται τρία μη συνδεδεμένα ηλεκτρόνια, υπάρχει μια υποστήριξη 1 2s ενός ηλεκτρονίου στο υποεπίπεδο 2p.
Έτσι το μοτίβο γίνεται 1s2 2s2 2px1 2py1.
Ωστόσο, για να ληφθεί το επίπεδο τριγωνικό σχήμα του επιθέματος BCl3, υποστηρίζεται ο υβριδισμός sp2 πριν από την υποστήριξη της δομής σύνδεσης.
Ο υβριδισμός Boro Gesta SP2 χρησιμοποιεί με ενθουσιασμό ένα 2s και δύο 2p τροχιές για να παρέχει τρεις μισογεμάτες διασταυρούμενες τροχιές sp2 γνωστές ως ισορροπία τριγωνικού επιπέδου. Σχηματίζει επίσης τρεις δεσμούς sp-p με τρεις τίτλους χλωρίου χρησιμοποιώντας το μισογεμισμένο υβριδικό κατιόν sp2. Για τη διαμόρφωση σ-σύνδεσης χρησιμοποιείται ένα μισογεμάτο β-τροχιακό.
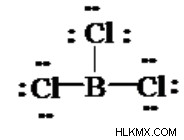
BCl ₃ Δομή Lewis
Η δομή BCl3 lewis είναι ανάλογη με το BF 3 (τριφθοριούχο βόριο) και το BBr 3 (τριβρωμιούχο βόριο) καθώς τα F και Br εμπίπτουν στην ομάδα 7 και περιλαμβάνει 7 ηλεκτρόνια σθένους.
Το βόριο απαιτεί μόνο 6 ηλεκτρόνια αντί για 8 για να δημιουργήσει ένα οκτρόνιο.
Μπορείτε να υπολογίσετε τις επίσημες χρεώσεις εάν δεν είστε σίγουροι ότι έχετε απλώς μια βέλτιστη δομή BCl ₃ Lewis. Θα εξετάσετε ότι το Β σε BCl ₃ περιλαμβάνει μόνο 6 ηλεκτρόνια σθένους.
Ένα άθροισμα 24 ηλεκτρονίων σθένους περιλαμβάνεται στη δομή BCl ₃ Lewis.
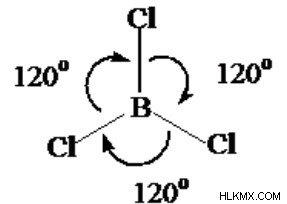
BCl3 Γωνίες Δεσμού
Το πρώτο βήμα για τον υπολογισμό των γωνιών σύνδεσης του BCl3 είναι να φτιάξετε τη δομή Lewis.
Για περίπτωση, το BCl3 μπορεί να είναι ένα τριγωνικό επίπεδο, και επομένως είναι μια γωνία δεσμού 120⁰. Ωστόσο, όταν είναι πολικό, δεν μπορεί επίσης να έχει γωνίες δεσμού ακριβώς 120⁰ αν είναι τριγωνικό επίπεδο σχήμα.
Η γωνία δεσμού BCl ₃ θα είναι μικρότερη από 120⁰ εάν το έμπλαστρο διατηρεί δύο σχετικές ομάδες και μόνο ένα στήριγμα ηλεκτρονίων και προκαλεί ένα δόλιο μοριακό σχήμα. Χάρη στα μοναχικά ηλεκτρόνια στήριξης, οι μύτες που έχουν ανάλογες μορφές σφαίρας μπορούν να έχουν διακριτά μοριακά σχήματα.
Συμπέρασμα
Οι επιστήμονες της ιστορίας παρατήρησαν ότι η διαμόρφωση ηλεκτρονίων κάτω κατάστασης δεν αντιστοιχούσε στην ποσότητα των ομοιοπολικών δεσμών που σχηματίστηκαν αυτά τα στοιχεία σε πολλά σύνθετα υλικά ούτε εξήγησε τις γωνίες μοριακού σχήματος/δεσμού που προσδιορίστηκαν πειραματικά. Σε απάντηση, η αρχή του τροχιακού υβριδισμού αναπτύχθηκε για να βοηθήσει στην εξήγηση του τι πραγματικά παρατηρείται στον φυσικό κόσμο. Ωστόσο, για να ληφθεί το επίπεδο τριγωνικό σχήμα του επιθέματος BCl3, υποστηρίζεται ο υβριδισμός sp2 πριν από την υποστήριξη της δομής σύνδεσης.