Ποιοι είναι οι δύο τρόποι με τους οποίους οι κρύσταλλοι και οι μοριακές δομές επηρεάζουν τις ιδιότητες των ιοντικών ομοιοπολικών ενώσεων;
1. Σημείο τήξης και σημείο βρασμού:
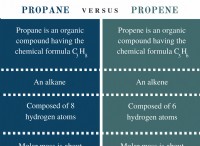
* Ιωνικές ενώσεις: Οι ιοντικές ενώσεις έχουν ισχυρά ηλεκτροστατικά αξιοθέατα μεταξύ των αντίθετα φορτισμένων ιόντων. Αυτές οι δυνάμεις είναι πολύ ισχυρές και απαιτούν μεγάλη ενέργεια για να ξεπεραστεί. Ως αποτέλεσμα, οι ιοντικές ενώσεις έχουν υψηλά σημεία τήξης και βρασμού. Η διάταξη των ιόντων στο κρύσταλλο πλέγμα επηρεάζει επίσης αυτές τις ιδιότητες. Για παράδειγμα, ένα εξαιρετικά συμμετρικό πλέγμα σαν μια κυβική δομή (FCC) με επίκεντρο το πρόσωπο οδηγεί γενικά σε υψηλότερα σημεία τήξης από ένα λιγότερο συμμετρικό πλέγμα.
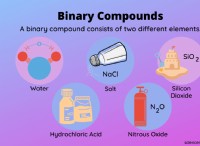
* ομοιοπολικές ενώσεις: Οι ομοιοπολικές ενώσεις περιλαμβάνουν την ανταλλαγή ηλεκτρονίων μεταξύ των ατόμων. Η δύναμη των διαμοριακών δυνάμεων (δυνάμεις μεταξύ μορίων) καθορίζει τα σημεία τήξης και βρασμού τους.
* ισχυρότερες διαμοριακές δυνάμεις: Αυτές οι δυνάμεις υπάρχουν σε ομοιοπολικές ενώσεις όπως νερό δεσμευμένο με υδρογόνο, με αποτέλεσμα υψηλότερα σημεία τήξης και βρασμού.
* ασθενέστερες διαμοριακές δυνάμεις: Οι ομοιοπολικές ενώσεις με ασθενέστερες δυνάμεις όπως οι δυνάμεις διασποράς του Λονδίνου έχουν χαμηλότερα σημεία τήξης και βρασμού. Για παράδειγμα, το μεθάνιο (CH4) έχει ένα πολύ χαμηλό σημείο βρασμού λόγω των ασθενών διαμοριακών δυνάμεων.
2. Διαλυτότητα:
* Ιωνικές ενώσεις: Οι ιοντικές ενώσεις τείνουν να είναι διαλυτές σε πολικούς διαλύτες όπως το νερό. Αυτό οφείλεται στο γεγονός ότι τα μόρια του νερού έχουν μερικό θετικό φορτίο στα άτομα υδρογόνου και ένα μερικό αρνητικό φορτίο στο άτομο οξυγόνου, επιτρέποντάς τους να αλληλεπιδρούν με τα ιόντα και να τα απομακρύνουν. Ωστόσο, οι ιοντικές ενώσεις είναι γενικά αδιάλυτες σε μη πολικούς διαλύτες (όπως το πετρέλαιο) επειδή τα μη πολικά μόρια διαλύτη δεν μπορούν να περιβάλλουν αποτελεσματικά τα φορτισμένα ιόντα.
* ομοιοπολικές ενώσεις: Οι ομοιοπολικές ενώσεις διαλύονται γενικά σε διαλύτες που έχουν παρόμοιες διαμοριακές δυνάμεις.
* Πολικές ομοιοπολικές ενώσεις: Οι πολικές ομοιοπολικές ενώσεις όπως η ζάχαρη (γλυκόζη) είναι διαλυτές σε πολικούς διαλύτες όπως το νερό. Αυτό οφείλεται στο γεγονός ότι τόσο ο διαλύτης όσο και η διαλυμένη ουσία έχουν παρόμοιες διαμοριακές δυνάμεις.
* Μη πολικές ομοιοπολικές ενώσεις: Οι μη πολικές ομοιοπολικές ενώσεις όπως το έλαιο είναι διαλυτές σε μη πολικούς διαλύτες όπως η βενζίνη. Αυτό οφείλεται στο γεγονός ότι οι αδύναμες διαμοριακές δυνάμεις (δυνάμεις διασποράς του Λονδίνου) στον διαλύτη μπορούν να ξεπεράσουν τις αδύναμες διαμοριακές δυνάμεις στη διαλυτή ουσία.
Συνοπτικά: Η δομή μιας ένωσης διαδραματίζει κρίσιμο ρόλο στον προσδιορισμό των ιδιοτήτων της. Για τις ιοντικές ενώσεις, οι ισχυρές ηλεκτροστατικές δυνάμεις λόγω του κρυσταλλικού πλέγματος οδηγούν σε υψηλά σημεία τήξης/βρασμού και διαλυτότητα σε πολικούς διαλύτες. Για τις ομοιοπολικές ενώσεις, η αντοχή των διαμοριακών δυνάμεων μεταξύ των μορίων διέπει τις ιδιότητές τους, επηρεάζοντας τα σημεία τήξης/βρασμού τους και τη διαλυτότητα σε διαλύτες με παρόμοιες ενδομοριακές δυνάμεις.